1、选择题 下列化学反应属于“氮的固定”的是( )
A.氯化铵加热分解产生NH3
B.硝酸工厂用NH3氧化制NO
C.N2与H2合成NH3
D.由NH3和硫酸反应制取硫酸铵
2、选择题 下列有关物质的性质叙述不正确的是
A.臭氧可用于自来水的消毒,是由于臭氧具有强的氧化性
B.纤维素水解后的溶液能与新制氢氧化铜悬浊液反应,说明纤维素是还原性糖
C.工业上生产氨气时可以用分离出氨气的方法提高转化率,是利用氨易液化的性质
D.氧化铝能与氢氧化钠溶液反应,又能与盐酸反应,是因为氧化铝是两性氧化物
3、填空题 合成氨对化学工业和国防工业具有重要意义.
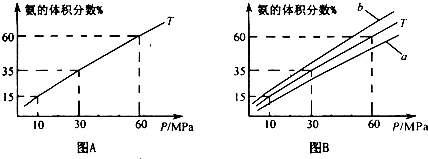
(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为T0C时平衡混合物中氨气的体积分数与压强(P)的关系图.
①写出工业上合成氨的化学方程式______.
②图A中氨气的体积分数为15.00%时,H2的转化率=______.
③图B中T=500°C,温度为4500C对应的曲线是______(选填字母“a“或“b”),选择的理由是______
④由图象知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是______(写出一条即可).
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O

CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
(3)一定温度下,在2L容器中发生上述反应,各物质的物质的量变化如下表
| 时间/min | CH4(mol) | H20(?mol) | CO?(mol) | H2?(mol)
0
0.40
1.00
0
0
5
X1
X2
X3
0.60
7
Y1
Y2
0.20
Y3
10
0.21
0.81
0.19
0.62
|
①分析表中数据,判断5?7min之间反应是否处于平衡状态______(填“是”或“否”),
前5min平均反应速率v(CH4)=______.
②反应在7~10min之间,CO的物质的量减少的原因可能是______(填字母).
a?减少CH4?b?降低温度c?增大压强d?充入H2
③若保持温度不变,向1L容器中起始充入0.15mol?CH4.0.45mol?H2O.______mol?CO、______mol?H2,达到平衡时CH4的体积百分含量与第一次投料相同.
4、选择题 2007年诺贝尔化学奖授予德国化学家GerhardErtl,以表彰他在表面化学领域研究所取得的开拓性成就。某反应在Pt/Al2O3/Ba催化剂表面吸附与解吸作用的机理如图所示(图中HC表示碳氢化合物,mtrate指硝酸盐),该机理研究是指
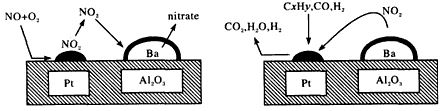
[? ]
A.汽车尾气催化转化处理
B.钢铁生锈机理
C.合成氨工业催化氧化机理
D.氢氧燃料电池电极反应机理
5、填空题 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为N2+3H2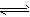 2NH3,则在电化学合成氨的过程中,阳极反应式为________________,阴极反应式为______________。
2NH3,则在电化学合成氨的过程中,阳极反应式为________________,阴极反应式为______________。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)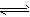 2NH3(g) △H<0,其化学平衡常数K与t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与t的关系如下表:
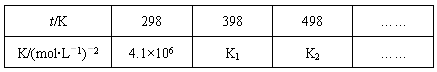
①试确定K1的相对大小,K1____________ 4.1×106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是____________ (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.2v(N2)(正) = v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)①NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是____________ 。
②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为___________
A.[Cl-]>[NH4+]>[H+]>[OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]>[NH4+]>[OH-]>[H+]
D.[NH4+]>[Cl-]>[H+]>[OH-]