1、选择题 在密闭容器中发生下列反应;aA(g) cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是
cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是
①平衡向正反应方向移动了?②平衡向逆反应方向移动了
③A的转化率增大?④正、逆速率都增大
A.②④
B.①③
C.③④
D.①②
2、选择题 下列说法正确的是
A.可逆反应的特征是正反应速率和逆反应速率相等
B.对已达到化学平衡的反应仅改变浓度,若平衡移动,则平衡常数(K)一定不变。
C.电镀时应把镀件置放电解槽的阳极。
D.电解AlCl3来制取金属铝。
3、选择题 已知一定温度和压强下,合成氨反应:N2(g)+3H2(g) 2NH3(g);△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为α1,放出热量为Q1。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时测得NH3的转化率为α2,吸收热量为Q2。下列说法错误的是?(?)
2NH3(g);△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为α1,放出热量为Q1。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时测得NH3的转化率为α2,吸收热量为Q2。下列说法错误的是?(?)
A.Q1 + Q2 = 92.0KJ
B.α1 + α2 = 1
C.Q1 + Q2 = 184.0KJ
D.α1/α2 = Q1/ Q2
4、选择题 为进一步提高合成氨的生产能力,科研中最有开发价值的是?(?)。
A.研制高温下活性较大的催化剂
B.寻求氮气的新来源
C.研制低温下活性较大的催化剂
D.研制耐高温和高压的新材料建造合成塔
5、填空题 在温度t1和t2下,X2(g)和 H2反应生成HX的平衡常数如下表:
化学方程式
| K (t1 )
| K (t2)
|
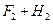 ? ? 2 2
| 1.8 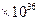
| 
|
  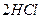
| 
| 
|
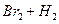  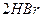
| 
| 
|
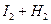  2HI 2HI
| 43
| 34
|
(1)已知t2〉t1,HX的生成反应是?反应(填“吸热”或“放热”)。
(2)HX的电子式是??。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是??。
(4)X2都能与H2反应 生成HX,用原子结构解释原因:??。
生成HX,用原子结构解释原因:??。
(5)K的变化体现出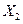 化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a. 在相同条件下,平衡于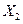 的转化率逐渐降低
的转化率逐渐降低
b. 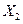 与
与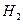 反应的剧烈程度逐渐减弱
反应的剧烈程度逐渐减弱
c. HX的还原性逐渐
d. HX的稳定性逐渐减弱