1、选择题 在一定温度下,下列叙述中属于可逆反应A(g)+B(g) 2C(g)达到平衡标志的是(?)
2C(g)达到平衡标志的是(?)
A.C的生成速率与C的分解速率相等
B.混合气体的压强不再变化
C.单位时间内消耗a mol A的同时消耗a mol B
D.A、B、C的物质的量之比为1∶1∶2
参考答案:A
本题解析:可逆反应达平衡时,v(正)=v(逆),混合气体的物质的量不再变化对于该反应不合适,因该反应前后,压强始终不变。
本题难度:简单
2、选择题 在三个密闭容器中分别充入N2、H2、HCl三种气体,当它们的温度和密度都相同时,这三种气体的压强(p),从大到小的顺序是
A.p(N2)>p(H2)>p(HCl)
B.p(HCl)> p(N2)> p(H2)
C.p(H2)> p(HCl)> p(N2)
D.p(H2)> p(N2)> p(HCl)
参考答案:D
本题解析:略
本题难度:简单
3、填空题 2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:
A(g)+2B(g)?C(g)+D(g),
在不同温度下,D的物质的量n(D)和时间t的关系如图
试回答下列问题:
(1)800℃时.0-5min内,以B表示的平均反应速率为______.
(2)能判断该反应达到化学平衡状态的标志是______.
A.容器压强不变B.混合气体中c(A)不变
C.2v正(B)=v逆(D)D.c(A)=c(C)
E.混合气体的平均分子量不再改变F.混合气体密度不变
G.A:B:C:D=1:2:1:1
(3)利用图中数据计算800℃时的平衡常数K=______,B的平衡转化率为:______.
该反应为______反应(填吸热或放热).
(4)800℃时,另一2L容积不变的密闭容器中,测得某时刻各物质的量如下:
n(A)=2.2mol,n(B)=5.2mol,n(C)=1.8mol,n(D)=1.8mol,则此时该反应______进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”).
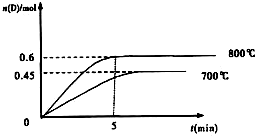
参考答案:(1)800℃时.0-5min内,D的平均化学反应速率v(D)=△nV△t=0.6mol2L5min=0.06mol/Lmin,同一反应中,各物质的反应速率之比等于计量数之比,所以v(B):v(D)=2:1=v(B):0.06mol/Lmin,v(B)=0.12mol?L-1?min-1;
故答案为:0.12mol?L-1?min-1;
(2)该反应是反应前后气体体积减小的反应,反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
A:该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故A正确.
B、反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,故B正确;
C、2v正(B)=v逆(D),速率之比不等于化学计量数之比,反应未达平衡状态,故C错误.
D、无论反应是否达到平衡状态,c(A)=c(C),所以不能作为判断平衡状态的依据,故D错误.
E、反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量不变,混合物的质量不变,所以混合气体的平均分子量不再改变,所以能作为化学平衡状态的判断依据,故E正确.
F、根据质量守恒,无论反应是否达平衡状态,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故F错误.
G、反应按照n(A):n(B):n(C):n(D)=1:2:1:1进行,开始n(A):n(B)不是1:2;到达平衡后,n(A):n(B):n(C):n(D)一定不是1:2:1:1,故G错误.
故答案为:ABE
(3)A(g)+2B(g) C(g)+D(g),
C(g)+D(g),
起始 1.0mol 2.2mol 0 0
反应0.6mol1.2mol 0.6mol0.6mol
平衡0.4mol 1.0mol 0.6mol0.6mol
平衡时A、B、C、D各物质的浓度分别为0.2mol/L、0.5mol/L、0.3mol/L、0.3mol/l、
化学平衡常数K=0.3mol/L×0.3mol/L0.2mol/L×(0.5mol/L)2=1.8(mol?L-1)-1;
B的平衡转化率=1.2mol2.2mol×100%=54.5%;
根据图象知,降低温度,D的含量减少,所以平衡向逆反应方向移动,故正反应是吸热反应.
故答案为:1.8(mol?L-1)-1;54.5%;吸热.
(4)A、B、C、D各物质的浓度分别为1.1 mol/L、2.6 mol/L、0.9 mol/L、0.9 mol/L
浓度商QC=0.9mol/L×0.9mol/L1.1mol/L×(2.6mol/L)2=0.11(mol?L-1)-1<1.8(mol?L-1)-1,所以反应向正反应方向进行.
故答案为:向正反应方向.
本题解析:
本题难度:一般
4、简答题 (1)25℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取lmolN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是______92.4kJ.(填“小于”,“大于”或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是______.
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
v正(NH3)=v逆(H2)
C.容器内的密度不再变化
D.单位时间内消耗amolN2,同时生成2amolNH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为______.向此溶液中加入少量的氯化铵固体,此时值将______(填“增大”,“减小”或“不变”).
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=______时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
参考答案:(1)①由N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol可知,生成2mol氨气放出92.4kJ热量;l molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,由于可逆反应不可能完全转化,所以生成氨气的物质的量小于2mol,放出的热量小于92.4kJ,
故答案为:小于;
②A.NH3生成的速率与NH3分解的速率相等,表明正逆反应速率相等,达到了平衡状态,故A正确;
B.混合气体的反应速率23v正(NH3)=v逆(H2),表示的是正逆反应速率,但是不满足化学计量数关系,所以正逆反应速率不相等,没有达到平衡状态,故B错误;
C.容器内的密度不再变化,该反应两边都是气体,气体的质量不变,反应中容器的容积不变,根据ρ=mV可知,密度在反应过程中始终不变,所以密度不能作为判断平衡状态的依据,故C错误;
D.单位时间内消耗a mol N2,同时生成2a mol NH3,表示的都是正反应速率,无法判断正逆反应速率是否相等,故D错误;
故选A;
(2)氨水溶液PH=11,则c(H+)═10-11 mol?L-1,c(0H-)═10-3mol?L-1,
NH3?H2O?NH4++OH-
起始(mol?L-1) 0.1 00
反应(mol?L-1)-)10-3 10-3 10-3
平衡(mol?L-1) 0.1 10-310-3
NH3?H2O的电离平衡常数为:10-3×10-30.1=1.0×10-5;
向此溶液中加入少量的氯化铵固体,溶液中铵离子浓度增大,氨水的电离程度减小,所以氢氧根离子浓度减小,此时c(NH+4)c(OH-)值将增大,
故答案为:10-5;增大;
(3)0.001mol/LAlCl3溶液中铝离子浓度为0.001mol/L,带人Ksp[Al(OH)3]=c(Al3+)×[c(OH-)]3可得:c(OH-)=1.0×10-10mol/L,常温下,氢离子浓度为:1.0×10-4mol/L,溶液pH=4,
故答案为:4.
本题解析:
本题难度:一般
5、选择题 已知反应2CH3OH(g) CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
物质
| CH3OH
| CH3OCH3
| H2O
|
浓度/mol·L-1
| 0.44
| 0.6
| 0.6
|
?
下列叙述中正确的是
A.该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c(CH3OH)
B.此时正、逆反应速率的大小:υ正<υ逆
C.若经10min后反应达到平衡,此时c(CH3OH)=0.04mol/( L·min)
D.0~10min内平均反应速率υ(CH3OH)=1.6mol/(L·min)
参考答案:C
本题解析: A、该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c2(CH3OH),错误;B、此时浓度商Q=(0.6×0.6)/0.442=1.86<400,反应正向进行,υ正>υ逆,错误;C、c(CH3OH)=0.04mol/( L·min)时,c(CH3OCH3)=0.04mol/( L·min)=c(H2O)=0.8mol/( L·min),Q=(0. 8×0.8)/0.042=400,反应达到平衡,正确。D、0~10min内平均反应速率υ(H2O)=0.06mol/(L·min),υ(CH3OH),2υ(H2O)=0.12mol/(L·min),错误。
本题难度:一般