1、填空题 “嫦娥一号”登月成功,实现了中国人“奔月”梦想.
“嫦娥一号”使用的推进剂是液氢和液氧,已知在298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热学方程式:
H2(g)+
O2(g)═H2O(l)△H=-285.8kJ/mol
C(g)+O2(g)═CO2(g)△H=-393.8kJ/mol
C8H18(l)+O2(g)═8CO2(g)+9H2O(l)△H=-5518kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol
相同质量的H2、C、C8H18、CH4完全燃烧时,放热最多的物质是放热最少的物质的放热量的______倍.(保留2位有效数字)
(2)已知:H2(g)═H2(l)△H=-0.92kJ/mol
O2(g)═O2(l)△H=-6.84kJ/mol
H2O(l)═H2O(g)△H=+44.0kJ/mol
请写出液氢和液氧生成气态水的热化学方程式:______.
(3)氢气、氧气不仅燃烧能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解质溶液为KOH溶液,其电池反应式为:
负极:______;正极:______.
参考答案:(1)设质量都为m,相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量分别是m2×285.8kJ、m12×393.5kJ、m114×5518kJ、m16×890.3kJ,最大值应为m2×285.8kJ,最小值是m12×393.5kJ,放热最多的物质是放热最少的物质的放热量的4.4倍,故答案为:4.4;
(2)①H2(g)═H2(l)△H=-0.92kJ/mol
②O2(g)═CO2(l)△H=-6.84kJ/mol
③H2O(l)═H2O(g)△H=+44.0kJ/mol
根据盖斯定律,液氢和液氧生成气态水的热化学方程式可以是③-①-12×②,焓变也是相应的代数和,所以液氢和液氧生成气态水的热化学方程式为H2(l)+12O2(l)═H2O(g)△H=-237.5kJ/mol;
(3)负极的反应中氢气失电子被氧化,氢气失电子生成氢离子,氢离子和溶液中的氢氧根离子生成水,所以电极反应式为2H2+4OH--4e-=4H2O;正极上是氧气得电子被还原,氧气得电子和水反应生成氢氧根离子,所以电极反应式为O2+2H2O+4e-=4OH-.
故答案为:2H2+4OH--4e-=4H2O;O2+2H2O+4e-=4OH-.
本题解析:
本题难度:一般
2、填空题 盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= -24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= -47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式: _________________
参考答案:CO(g)+FeO(s) == Fe(s)+CO2(g) △H=-218.0kJ/mol
本题解析:
本题难度:一般
3、简答题 (1)写出H2S的电离方程式______;
(2)写出熔融状态下硫酸氢钠的电离方程式______;
(3)已知1g氢气完全燃烧生成液态水放出143KJ热量,写出表示H2燃烧热热化学方程式______;
(4)已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)=CaSiO3(s)△H3
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
用△H1、△H2和△H3表示△H,△H=______.
参考答案:(1)H2S属于二元弱酸,存在电离平衡,H2S电离氢离子与硫氢根离子,电离方程式为:H2S?H++HS-HS-;
硫氢根离子发生二级电离,电离出氢离子与硫离子,电离方程式为:HS-?H++S2-;
故答案为:H2S?H++HS-HS-、HS-?H++S2-;
(2)硫酸氢钠是离子化合物,由钠离子与硫酸氢根离子构成,熔融状态下电离出钠离子与硫酸氢根离子,电离方程式为:NaHSO4=Na++HSO4-;
故答案为:NaHSO4=Na++HSO4-;
(3)1g氢气的物质的量为1g2g/mol=0.5mol,所以1mol氢气完全燃烧生成液态水放出的热量为143kJ×1mol0.5mol=286kJ,所以H2燃烧热的热化学方程式为:H2(g)+12O2(g)=H2O(l)△H=-286kJ?mol-1;
故答案为:H2(g)+12O2(g)=H2O(l)△H=-286kJ?mol-1;
(4)已知:①4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
②2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
③SiO2(s)+CaO(s)=CaSiO3(s)△H3
根据盖斯定律,①+②×3+③×18得:
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
△H=△H1+3△H2+18△H3;
故答案为:△H1+3△H2+18△H3.
本题解析:
本题难度:一般
4、填空题 一氧化碳是一种用途相当广泛的化工基础原料.
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.
Ni(s)+4CO(g)?
Ni(CO)4(g)?该反应的△H______0(选填“>”或“=”或“<”).
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
C(s)+O2(g)=CO2(g);△H1=-393.5kJ?mol-1
CO2(g)+C(s)=2CO(g);△H2=+172.5kJ?mol-1
S(s)+O2(g)=SO2(g);△H3=-296.0kJ?mol-1
请写出CO除SO2的热化学方程式______.
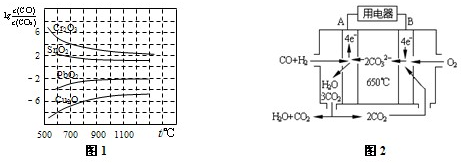
(3)金属氧化物被一氧化碳还原生成金属单质和二氧化碳如图1是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K=______.800℃时,其中最易被还原的金属氧化物是______(填化学式),该反应的平衡常数数值(K)等于______.
(4)如图2是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出B极发生的电极反应式______.
参考答案:(1)反应Ni(s)+4CO(g)?
Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;
(2)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3=-270?kJ?mol-1,故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270?kJ?mol-1;
(3)一氧化碳还原三氧化铬反应的化学方程式为:3CO+Cr2O3?高温?.?2Cr+3CO2,则K=cCO23cCO3,800℃时,K越大,金属氧化物越易被还原,故Cu2O越易被还原,lg1K=-6,则K=106,故答案为:cCO23cCO3;Cu2O;106;
(4)碳酸盐燃料电池中通氧气的电极一定为正极,氧气在该电极上发生还原反应,故答案为:2CO2+O2+4e-=2CO32-.
本题解析:
本题难度:一般
5、填空题 氨在国民经济中占有重要的地位.
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气.
C(s)+H2O(g)?H2(g)+CO(g);△H=+131.3kJ/mol;△S=+133.7J/(mol?K).该反应在较低温度下能否自发进行______(填“能”或“不能”)
(2)已知在400°C时,2NH3(g)?N2(g)+3H2(g);△H>0的K=2.
①400°C时,N2(g)+3H2(g)?2NH3(g)的K=______(填数值)
②400°C时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时v(NH3)正______v(NH3)逆(填“大于”、“小于”、“等于”、“不确定”)
(3)体积相同的甲、乙两个容器中,分别充入等物质的量的氮气和氢气,在相同温度下发生反应N2(g)+3H2(g)?2NH3(g)并达到平衡,在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则甲容器中氮气的转化率______乙容器中氮气的转化率(填“大于”、“小于”或“等于”)
(4)已知:1/2N2(g)+3/2H2(g)=NH3(g);△H=-46.0kJ/mol
H2(g)+1/2O2(g)=H2O(l);△H=-285.8kJ/mol
1/2N2(g)+O2(g)=NO2(g);△H=+33.9kJ/mol
H2O(l)=H2Og);△H=+44kJ/mol则氨气燃烧热的热化学方程式为______.
参考答案:(1)为使反应能自发进行,则有△G=△H-T?△S=+131.3kJ/mol-T×10-3×(+133.7kJ/(mol?K))<0,
T>131.3×103133.7=982K,在较低温度下不能自发进行,故答案为:不能;
(2)①由题意可知:K1=c(N2)?c3(H2)c2(NH3)=2,则K2=c2(NH3)c(N2)c3(H2)=0.5,故答案为:0.5;?
②一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,
则c(N2)=4mol/L,c(H2)=2mol/L,c(NH3)=4mol/L,
则K2=c2(NH3)c(N2)c3(H2)=424×23=0.5,说明反应达到平衡状态,则有v(NH3)正=v(NH3)逆,
故答案为:等于;
(3)甲容器保持体积不变,乙容器保持压强不变,随着反应的进行,甲容器中的压强逐渐减小,因增大压强平衡向正反应方向移动,
则甲容器中氮气的转化率小于乙容器中氮气的转化率,故答案为:小于;
(4)已知:①12N2(g)+32H2(g)=NH3(g)△H=-46.0kJ/mol;
②H2(g)+12O2(g)=H2O(l)△H=-285.8kJ/mol;
③12N2(g)+O2(g)=NO2(g)△H=+33.9kJ/mol;
④H2O(l)=H2O(g)△H=+44kJ/mol;
由盖斯定律可知,将②×32+③-①可得NH3(g)+74O2(g)=NO2(g)+32H2O(l),
其反应热△H=(=-285.8kJ/mol)×32+(+33.9kJ/mol)-(-46.0kJ/mol)=-348.8kJ/mol,
则氨气燃烧热的热化学方程式为:NH3(g)+74O2(g)=NO2(g)+32H2O(l)△H=-348.8kJ/mol,
故答案为:NH3(g)+74O2(g)=NO2(g)+32H2O(l)△H=-348.8kJ/mol.
本题解析:
本题难度:简单