1、选择题 根据下列热化学方程式
(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(2)H2(g)+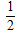 O2(g)=2H2O(l)△H2=-285.8kJ/mol
O2(g)=2H2O(l)△H2=-285.8kJ/mol
(3)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
A.△H=244.1kJ/mol
B.△H=-488.3kJ/mol
C.△H=-996.6kJ/mol
D.△H=996.6kJ/mol
参考答案:B
本题解析:
本题难度:一般
2、选择题 一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4?(?g?)+4NO2(?g?)=4NO(?g?)+CO2(?g?)+2H2O(?g?)△H=一574kJ?mol-1
②CH4?(?g?)+4NO(?g?)=2N2(?g?)+CO2(?g?)+2H2O(?g?)△H=一1?160kJ?mol一1.
下列正确的选项是( ? )
A.CH4?(?g?)+2NO2?(?g?)=N2(?g?)+CO2?(?g?)+2H2O?(?l)△H=一867?kJ?mol-1
B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2?mol
C.若0.2?mol?CH4还原NO2至N2,在上述条件下放出的热量为173.4?kJ
D.若用标准状况下4.48L?CH4?还原NO2至N2,整个过程中转移的电子总数为3.2?mol
参考答案:C
本题解析:
本题难度:简单
3、选择题 在25℃ 101kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为
P4(s)+5O2(g)= P4O10(s);△H = -3093.2 kJ/mol,
4P(s)+5O2(g)= P4O10(s);△H = -2954.0 kJ/mol,
由此判断,下列说法正确的是
[? ]
A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
参考答案:D
本题解析:
本题难度:一般
4、选择题 已知热化学方程式:
① C2H2(g) +5/2O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ·mol-1
② C(s)+ O2(g) == CO2(g) △H2=-393.5 kJ·mol-1
③ H2(g)+ 1/2O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) == C2H2(g)的△H4为
[? ]
A.+228.2 kJ·mol-1
B.-228.2 kJ·mol-1
C.+1301.0 kJ·mol-1
D.+621.7 kJ·mol-1
参考答案:A
本题解析:
本题难度:一般
5、简答题 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大火炬燃料是丙烯(C3H6)
(1)丙烷脱氢可得丙烯.已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ?mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ?mol-1 则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=______kJ?mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2,负极通入丙烷,电解质是熔融碳酸盐.电池总反应方程式为______;放电时,CO32-移向电池的______(填“正”或“负”)极.
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=______.(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=______.(已知:10-5.60=2.5×10-6)
(4)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是______(用离子方程式和文字说明)
参考答案:(1)由C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ?mol-1①,
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ?mol-1 ②,
则根据盖斯定律,反应C3H8(g)→CH3CH=CH2(g)+H2(g)可由①-②得到,
所以△H=△H1-△H2=+156.6kJ?mol-1-(+32.4kJ?mol-1)=+124.2kJ?mol-1,故答案为:+124.2;
(2)负极通入丙烷,碳元素的化合价升高,电池的正极通入O2,氧元素的化合价降低,即丙烷与氧气反应生成二氧化碳和水,
则电池的总反应为C3H8+5O2═3CO2+4H2O,原电池中阴离子向负极移动,即CO32-移向电池的负极,
故答案为:C3H8+5O2═3CO2+4H2O;负;
(3)忽略水的电离及H2CO3的第二级电离,pH=5.60,c(H+)=10-5.60=2.5×10-6mol?L-1,
由H2CO3 HCO3-+H+,
HCO3-+H+,
平衡时c(H+)=c(HCO3-)=2.5×10-6mol?L-1,
c(H2CO3)=(1.5×10-5-2.5×10-6)mol?L-1,
则Ka=c(H+)×c(HCO3-)c(H2CO3)=4.2×10-7 mol?L-1,故答案为:4.2×10-7 mol?L-1;
(4)NaHCO3溶液的pH大于8,则水解大于电离,水解生成H2CO3,电离生成CO32-,即HCO3- CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-,
所以c(H2CO3)>c(CO32-),故答案为:>;HCO3- CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-.
H2CO3+OH-.
本题解析:
本题难度:一般