1、选择题 电子表和电子计算机的电源通常用微型银-锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液总反应式:Ag2O + H2O+ Zn=Zn(OH)2 + 2Ag 下列说法正确的是
A.Ag2O是正极, Zn是负极
B.Zn是正极,Ag2O是负极
C.工作时,电池负极区溶液PH增大
D.工作时,电子由Ag2O极经外电路流向Zn极
参考答案:A
本题解析:根据总反应式可知氧化银得到电子被还原,锌失去电子被氧化。因此氧化银是正极,锌是负极,电子经外电路由氧化银流向锌极,其中负极电极反应式为Zn-2e-+2H2O=Zn(OH)2+2H+。所以正确的答案是A。
本题难度:简单
2、填空题 为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图:
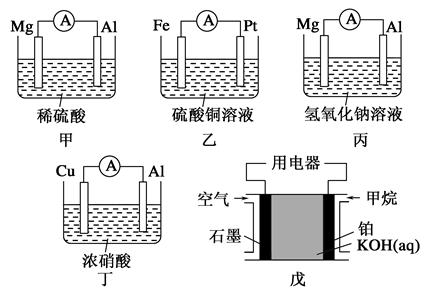
回答下列问题:
(1)根据原电池原理填写下表:
装置序号
| 正极
| 负极反应式
| 阳离子移动方向
|
甲
| ?
| ?
| ?
|
乙
| ?
| ?
| ?
|
丙
| ?
| ?
| ?
|
丁
| ?
| ?
| ?
|
戊
| ?
| ?
| ?
|
?
(2)电极类型除与电极材料的性质有关外,还与________有关。
(3)根据上述电池分析,负极材料是否一定参加电极反应?_____
(填“是”“否”或“不一定”),请举例说明:__________________________________________。
(4)指出下列电池的放电过程中,电解质溶液酸碱性的变化:甲_______,丙_______,戊_______。(填酸性或碱性增强或减弱)
参考答案:(1)
装置
序号
正极
负极反应式
阳离子
移动方向
甲
Al
Mg-2e-=Mg2+
铝极
乙
Pt
Fe-2e-=Fe2+
铂极
丙
Mg
Al-3e-+4OH-=AlO2-+2H2O
镁极
丁
Al
Cu-2e-=Cu2+
铝极
戊
石墨
CH4-8e-+10OH-=CO32-+7H2O
石墨
?
(2)电解质溶液的性质
(3)不一定 上述五个原电池中,戊装置的负极材料没有参与反应,其他电池的负极发生了氧化反应
(4)酸性减弱 碱性减弱 碱性减弱
本题解析:(1)电池甲:在稀硫酸中,镁比铝活泼,镁为负极,发生氧化反应,铝为正极,H+在铝极上发生还原反应;
乙电池:铁比铂活泼,铁为负极;
丙电池:在氢氧化钠溶液中,铝与NaOH溶液反应,铝失去电子,发生氧化反应,铝离子与氢氧化钠反应生成偏铝酸根离子和水;
丁电池:常温下,浓硝酸使铝钝化,铜溶解,铜为负极;
戊电池是燃料电池,甲烷与氧气反应,甲烷发生氧化反应,在碱中生成碳酸盐和水,氧气发生还原反应。所以。在负极区通入甲烷,在正极区通入空气。
(2)通过比较甲、丙电池可知,电极都是铝、镁,由于电解质溶液不同,故电极名称不同,即电极类型与电极材料、电解质溶液都有关。
(3)大多数电池的负极材料参与反应发生氧化反应,燃料电池的负极材料不参与反应,可燃物如氢气、一氧化碳、甲烷、乙醇等在负极区发生氧化反应。
(4)根据溶液中离子参加反应情况判断溶液酸碱性的变化。
本题难度:一般
3、选择题 两种金属A与B组成原电池时,A是正极。下列有关推断正确的是
[? ]
A.A的金属性强于B
B.A电极上发生的电极反应是还原反应
C.电子不断由A电极经外电路流向B电极
D.A在金属性活动顺序表中一定排在氢前面
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列装置或操作能达到实验目的是( )
A.
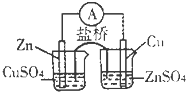
构成铜锌原电池
B.
二氧化碳制取装置
C.
利用排空气法收集CO2
D.

实验室制取并收集氨气
参考答案:A.原电池构成条件是活泼性不同的电极,电解质溶液,闭合回路,自发进行的氧化还原反应,盐桥的主要是起到导电作用,防止同种电荷离子间的影响;该装置中发生的电池反应是锌和铜离子的置换反应,该原电池中,锌的活泼性大于铜,所以锌作负极,铜作正极;正极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu;负极上锌失电子生成锌离子进入溶液,所以锌片逐渐溶解;外电路中,电子从负极锌沿导线流向正极铜;盐桥中的阴离子向硫酸锌溶液中迁移,阳离子向硫酸铜溶液中迁移,而图中锌插在硫酸铜溶液中,铜插在硫酸锌溶液中,假设锌能失去电子,沿导线进入铜极,因盐桥作用是平衡两个半电池中的阴阳离子,只有盐桥中的阴阳离子移动,左图中的硫酸铜中的铜离子无法得电子,所以应该是锌放在硫酸锌溶液中,而铜放在硫酸铜溶液中,故A错误;
B.实验室中制取二氧化碳常用大理石和稀盐酸反应来制取,化学方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O;药品的状态为:固体+液体,反应条件为:不需要加热,所以能选择B装置来制取二氧化碳气体,但导气管伸入液面以下,生成的气体无法逸出,故B错误;
C.CO2的密度大于空气的密度,所以收集CO2应长管进短管出,故C错误;
D.实验室用氯化铵和碱石灰反应制取氨气,即碱与盐反应生成新碱和新盐,化学方程式为:2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O,在收集氨气时氨气温度比空气温度高,收集的氨气的浓度小,容易逸出,因此在瓶口塞一团棉花,目的是防止氨气逸出,污染环境,氨气的密度小于空气的密度,用向下排空气法收集,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 下列说法正确的是
A.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: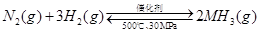 △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
B.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(CH3COOH) >c(Na+)>c(H+)>c(OH-)
C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键
D.在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl—)。用含a的代数式表示NH3·H2O的电离常数Kb=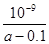
参考答案:C
本题解析:A不正确,因为是可逆反应,无法确定转化率,所以不能计算反应热。B不正确,因为醋酸要电离,所以醋酸的浓度不可能大于钠离子的浓度。环己烯(l)与环己烷(l)相比,形成一个双键,能量降低169kJ/mol,苯(l)与环己烷(l)相比,能量降低691kJ/mol,远大于169×3,说明苯环有特殊稳定结构,所以C正确。D中根据电荷守恒可知,溶液显中性,所以OH-的浓度是10-7mol/L,而溶液中c(NH4+)=0.005mol/L,剩余氨水的浓度是 ,所以NH3·H2O的电离常数Kb=
,所以NH3·H2O的电离常数Kb=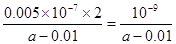 ,D不正确。
,D不正确。
本题难度:一般