1、实验题 “氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为:
___________________________
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ·mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ·mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H =-571.6kJ·mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ·mol-1
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg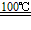 HgBr2+H2
HgBr2+H2
③HgBr2+CaO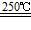 HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑
2Hg+O2↑
你认为该方法的主要缺点是____________________________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。
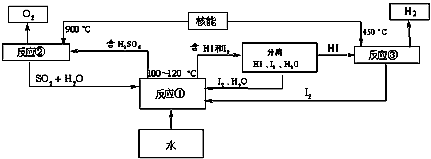
请写出反应①的化学方程式:____________________;用法制取氢气最大的优点是:______________;
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实?__________(填“不现实”或“现实”),说明能够支持你的观点的两点理由:______________________;____________________。
(5)实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾
(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质。制备皓矾的实验流程如下图所示。
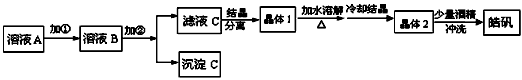
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)3:2.7~3.7 Fe(OH)2:7.6~9.6 Zn(OH)2:5.7~8.0
试回答下列问题:
①加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用
______,其理由是____________。
②加入试剂的②,供选择使用的有:Zn粉、ZnO、Zn(OH)2、Zn2CO3、ZnSO4等,应选用____________,其理由是______________。
③在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是_____________________。
参考答案:(1)BC?
(2)循环过程需要很高的能量,且使用重金属汞,会产生污染
(3)SO2+I2+2H2O 2HI+H2SO4;SO2和I2可循环使用,无污染
2HI+H2SO4;SO2和I2可循环使用,无污染
(4)不现实;现有的制取氢气方法耗能大,制取的成本太高;氢气的熔沸点太低,给储存和运输带来困难(或:现实;制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等)
(5)①20%的H2O2;将制氢废液中的Fe2+氧化成Fe3+,同时避免引入新的杂质。
②ZnO[Zn2CO3或Zn(OH)2)];调节溶液的pH至3.7-5.7,使得Fe3+完全转化为Fe(OH)3沉淀,同时避免引入新的杂质
③为了冲洗掉晶体表面的杂质离子,防止晶体溶解,影响产率
本题解析:
本题难度:困难
2、推断题 三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3·6H2O晶体。填写下列空白

(1)收集B处的气体可采用的方法是________________________。
(2)滴加盐酸时,发现反应速率较盐酸与纯铁粉反应的要快,其原因是________________________。
(3)烧杯内盛放过量稀HNO3的原因是___________________,反应的离子方程式是_________________。
(4)整个实验过程中,旋塞a都必须打开,除了为排出产生的气体外,另一个目的是___________________________________。
(5)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O,而不用直接蒸干的方法来制得晶体的理由是______________________。
参考答案:(1)排水集气法或向下排空气法
(2)废铁屑中有Cu杂质,形成了铜、铁原电池
(3)确保所有的Fe2+转化为Fe3+;3Fe2++4H++NO3-==3Fe3++NO↑+2H2O
(4)与大气相通,保证装置A中的液体顺利流下,便于过滤操作的顺利进行
(5)防止加热时FeCl3水解而得不到FeCl3·6H2O
本题解析:
本题难度:一般
3、实验题 某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。

请填写下列空白:
(1)乙醇发生催化氧化的化学反应方程式为________________________________________。
(2)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是____________________;由于装置设计上的缺陷,实验进行时可能会______________________________。
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。

试解释出现图中现象的原因:______________________________;你认为该实验中“鼓气速度”这一变量可用______________________________来计量。
参考答案:(1)2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
(2)得到平稳的C2H5OH蒸汽 ;倒吸
(3)开始随鼓气速度增加,反应的量增多放热多,后来,由于鼓气速度太快,末反应的气体将热量带走,温度下降 ;单位时间内甲中的气泡数
本题解析:
本题难度:一般
4、选择题 下列说法中正确的是?
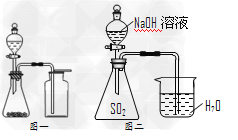
[? ]
A.氯气通入澄清石灰水中,制取漂粉精?
B.可用化合反应的方法制取Fe(OH)3
C.选择合适的试剂,用图一所示装置可分别?制取少量CO2、NO和O2
D.图二装置证明SO2与NaOH发生了反应(系统装置不漏气)
参考答案:B
本题解析:
本题难度:一般
5、实验题 二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表
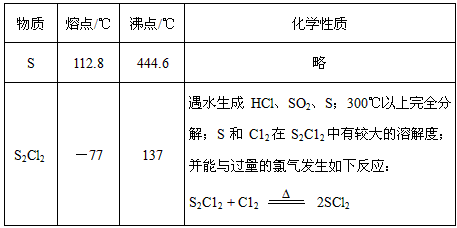
设计实验装置图如下:

⑴上图中有一处重大缺陷,请你提出改进意见: _________________________。利用改进后的正确装置进行实验,请回答下列问题:
⑵E中反应的化学方程式:________________________。
⑶C中的试剂是_______________________。长导管F有导气、_______________的作用。
⑷实验开始后,对于B、E两处酒精灯的点燃顺序是___________;
a.先B后E b.先E后B c.一起点燃
你选择的理由是___________。
⑸如果在加热E时温度过高,对实验结果的影响是__________________________。
⑹S2Cl2粗品中可能混有的杂质是(填写两种)______________、________________,为了提高S2Cl2的纯度,关键的操作是控制好温度和_________________。
参考答案:⑴在G和H之间增加干燥装置?
⑵2S+Cl2 S2Cl2?
S2Cl2?
⑶饱和食盐水;冷凝?
⑷a;防止装置内的氧气与S反应
⑸产率降低或产品中含有较多的杂质
⑹SCl2;Cl2(或S);控制浓盐酸的滴速不要过快
本题解析:
本题难度:困难