1、选择题 某温度下,将Cl2通入NaOH溶液中,反应得到NaCl.NaClO.NaClO3的混合溶液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A.21:5
B.11:3
C.3:1
D.4: 1
参考答案:D
本题解析:设ClO—与ClO3—的物质的量为1mol、3mol,此时失去的电子的物质的量为16mol,根据得失电子数相等,生成的Cl—为16mol,那么被还原的氯元素为16mol,被氧化的氯元素为4mol,被还原的氯元素与被氧化的氯元素的物质的量之比为4:1,故选D。
本题难度:一般
2、填空题 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-
参考答案:
本题解析:
本题难度:困难
3、选择题 在离子反应3Cu+yH++xNO3-=3Cu2++2NO+qH2O中,系数q的值为( )
A.1
B.4
C.3
D.2
参考答案:根据N原子守恒知,x=2,根据电荷守恒得:y-2=3×2,y=8,根据氢原子守恒得,8=2q,所以q=4,故选B.
本题解析:
本题难度:简单
4、选择题 实验室制Cl2的原理:MnO2+4HCl(浓)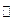 MnCl2+Cl2↑+2H2O,当制取1mol Cl2时,所需氧化剂与还原剂的物质的量之比为(?)
MnCl2+Cl2↑+2H2O,当制取1mol Cl2时,所需氧化剂与还原剂的物质的量之比为(?)
A.4:1
B.1:4
C.1:2
D.2:1
参考答案:C
本题解析:略
本题难度:简单
5、填空题 实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓)  MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是?mol,转移电子的物质的量是?mol。
(2)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 ??。
(3)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)?。
参考答案:(1)2? 2 (2)4Cl2+8NaOH = 6NaCl+NaClO3+NaClO+4H2O
(3)Cl-+ClO-+2H+ = Cl2↑+H2O
本题解析:(1)当1mol Cl2参加反应时,由Cl2~2HCl可知被氧化的HCl为1mol×2=2mol,转移电子的物质的量为:1mol×(4-2)=2mol;(2)由题意可知反应物为氯气和氢氧化钠,生成物为NaCl、NaClO3、NaClO和H2O,氯元素从0价变为NaClO3中+5价,两个氯原子失10个电子,氯元素从0价变为NaCl中-1价,两个氯原子得到2个电子,所以氯化钠前得系数为6,氯酸钠前的系数为1,再根据原子守恒就可得到反应的化学方程式为:4Cl2+8NaOH = 6NaCl+NaClO3+NaClO+4H2O;(3)次氯酸钠有强氧化性,盐酸有强还原性,两者相遇发生氧化还原反应生成氯气,故化学反应方程式为:Cl-+ClO-+2H+ = Cl2↑+H2O。2与浓盐酸反应制取氯气
本题难度:一般