1、填空题 向20 mL 某浓度的AlCl3溶液中滴入2 mol·L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
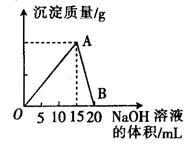
(1)图中A点表示的意义是______________。
(2)最大沉淀量是______________g。
(3)B点表示的意义是______________。
(4)所用AlCl3溶液的物质的量浓度是______________。
(5)当所得沉淀量为0.39克时,用去NaOH溶液的体积是_____ mL 或_______ mL。
参考答案:(1)AlCl3与NaOH恰好完全反应,生成最大沉淀量。(2)0.78 (3)Al(OH)3恰好与NaOH完全反应,沉淀完全溶解。(4)0.5mol/L?(5)? 7.5? 17.5? .
本题解析:向可溶性铝盐的溶液中滴加NaOH至过量,先生成沉淀,后溶液又变澄清;结合图像,当沉淀量不是最大值时消耗的NaOH的量即为两种可能。NaOH不足或达到最大沉淀量后,部分沉淀被过量的NaOH溶解。
本题难度:一般
2、选择题 下列实验现象、操作或反应原理的解释正确的是( )
| 现象、操作或反应 | 解释
A铝箔在酒精灯火焰上加热熔化不滴落
铝箔对熔化的铝有吸附作用
B向滴有稀硫酸的热淀粉液中滴加碘水,
? 液体呈蓝色
此条件下淀粉没有完全水解
C向pH试纸上滴加氯水,先变红后褪色
氯水显酸性
D鸡蛋清溶液遇乙酸铅溶液会产生沉淀
蛋白质发生盐析
|
A.A
B.B
C.C
D.D
参考答案:B
本题解析:
本题难度:简单
3、选择题
下列说法正确的是
[? ]
A.因为铝与氢氧化钠溶液可以发生反应,故不能用氢氧化钠溶液除去铝表面的氧化膜
B.金属钠可与水反应,故不能用金属钠置换其他金属
C.锌的活动性比铁强,可在海轮外壳上镶入锌块以减缓轮船腐蚀
D.铜绿的主要成分是氢氧化铜,可用酸除去铜绿
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列有关金属及其合金的说法不正确的是
[? ]
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢和不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
参考答案:B
本题解析:
本题难度:简单
5、简答题 将镁、铝的混合物0.1mol溶于100mL?2mol/L的H2S04溶液中,然后再滴加1mol/L的NaOH溶液.请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则金属粉末中,n(Mg)=______mol,V2=______mL.
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、A13+刚好沉淀完全,则滴入NaOH溶液的体积
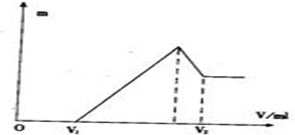
参考答案:(1)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=12n(Na+)=12n(NaOH)=12×0.16L×1mol/L=0.08mol
令MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1
根据SO42-离子守恒有:x+3y=0.2-0.08
联立方程,解得:x=0.06;y=0.02
所以金属粉末中n(Mg)=0.06mol,n(Al)=2y=2×0.02mol=0.04mol
滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L×+0.04mol=0.44mol,
所以,V2=0.44mol1mol/L=0.44L=440ml
故答案为:0.06mol,440?mL.
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2(H2SO4)=2×0.1L×2mol/L=0.4mol,所以,V(NaOH)=0.4mol1mol/L=0.4L=400ml
故答案为:400ml;
本题解析:
本题难度:一般