1、选择题 在H2SO4酸化过的Al2(SO4)3溶液中滴加NaOH溶液,生成沉淀W(g)与所加NaOH溶液体积V的关系如图,其中正确的是
[? ]
A
B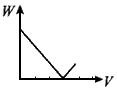
C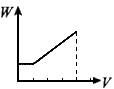
D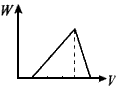
参考答案:D
本题解析:
本题难度:一般
2、填空题 依据经济性等要求设计实验方案,将4mol金属Al全部转化为Al(OH)3,共计消耗HCl?a?mol,NaOH?b?mol,则(a+b)的最合理值为______.
参考答案:生成4molAl(OH)3时,由反应方程式可知
方案①中:2Al+6H+=2Al3++3H2↑、Al3++3OH-=Al(OH)3↓+3NH4+,
?12?4? 4?12? 4
即消耗4molAl时,消耗12molH+、12molOH-,则a+b=24
方案②中:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、AlO2-+H2O+H+=Al(OH)3↓,
?4?4?4?4?4? 4
即消耗4molAl时,消耗4molH+、4molOH-,则a+b=8
方案③中:2Al+6H+=2Al3++3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑、Al3++3AlO2-+6H2O=4Al(OH)3↓,
?1? 3? ?1?3? 3?3? ?1?3? 4
即消耗4molAl时,消耗3molH+、3molOH-,则a+b=6
显然方案③最好,药品用量少,操作最为简单,
故答案为:6
本题解析:
本题难度:简单
3、选择题 将烧碱溶液和盐酸依次滴入某溶液A中,其沉淀(Y轴)和加入溶液的体积(X轴)的关系可能出现两种图示形式,则A溶液不可能是
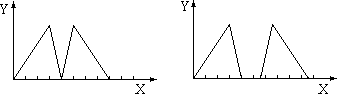
A.三溴化铝溶液
B.偏铝酸钠溶液
C.明矾溶液
D.硝酸铝溶液
参考答案:B
本题解析:偏铝酸钠溶液滴入氢氧化钠,溶液无现象,然后再滴加盐酸,则首先中和溶液中的氢氧化钠,若继续滴加盐酸,则氢氧化铝沉淀,方程式为NaAlO2+H2O+HCl=Al(OH)3↓。当沉淀不再发生变化时,再加入盐酸会溶解氢氧化铝,方程式为Al(OH)3+3HCl=AlCl3+3H2O,所以选项B不符合。答案选B。
本题难度:简单
4、选择题 将钠、铝混合物(质量A1g)投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体7.84L.向溶液中逐滴加入浓度为2mol?L-1的H2SO4溶液,至100ml时白色沉淀达到最大量.继续滴入H2SO4溶液,当加入H2SO4溶液的体积为xml时沉淀恰好消失.将所得溶液蒸干灼烧得固体A2g.下列关系式中不正确的是( )
A.沉淀达到最大量时溶液中的溶质为Na2SO4、NaHSO4
B.x=75ml
C.A1=11.9
D.白色沉淀最大量为7.8g
参考答案:A.将钠、铝混合物投入水中,发生的反应为2Na+2H2O═2NaOH+H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,向溶液中加入硫酸,当沉淀量最大时,发生的反应为2H2O+2NaAlO2+H2SO4=2 Al(OH)3↓+Na2SO4,溶液中的溶质是Na2SO4,故A错误;
B.当沉淀的量最大时,溶液中的溶质是硫酸钠,根据Na2SO4中钠离子和硫酸根离子的关系得n(Na)=2n(H2SO4)=0.4mol,根据转移电子相等得n(Al)=7.84L22.4L/mol×2-0.4mol×13=0.1mol,
根据铝原子守恒得n( Al(OH)3)=0.1mol,根据2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O知,需要硫酸的物质的量为0.15mol,则硫酸体积=0.15mol2mol/L=75mL,
故B正确;
C.通过以上分析知,n(Na)=0.4mol,n(Al)=0.1mol,所以A1=23g/mol×0.4mol+27g/mol×0.1mol=11.9g,故C正确;
D.根据原子守恒知,当沉淀最大时,n( Al(OH)3)=0.1mol,则m( Al(OH)3)=0.1mol×78g/mol=7.8g,故D正确;
故选A.
本题解析:
本题难度:简单
5、选择题 化学与生活、社会密切相关。下列说法不正确的是
[? ]
A.用浓H2SO4刻蚀工艺玻璃上的纹饰
B.用含Al(OH)3的药物治疗胃酸过多
C.用Ca(OH)2处理酸性废水
D.用加入Na2S的方法除去废水中的Hg2+
参考答案:A
本题解析:
本题难度:简单