1、计算题 (4分)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题:
(1)反应开始到10s,用X表示的反应速率为?
(2)反应的化学方程式为?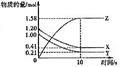
参考答案:ν(X)=ν(Y)=0.0395mol/(L·s)? X(g)+Y(g) 2Z(g)
2Z(g)
本题解析:略
本题难度:简单
2、选择题 把4mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+2B(s)  xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是(? )
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是(? )
A.A的平均反应速率为0.15 mol?L-1?min-1
B.平衡时,C的浓度为0.25mol?L-1
C.B的平均反应速率为0.1 mol?L-1?min-1
D.平衡时,容器内压强为原来的0.875倍
参考答案:C
本题解析:A.V(A):V(D)="3:1." V(D)=" 0.05mol/(" L?min),所以V(A)=" 0.15mol/(" L?min).正确。B.由于反应是在恒容的密闭容器内进行,达到平衡容器内压强变小,所以3>x+1.因此x="1." V(C):V(D)=1:1,故V(C)=" 0.05mol/(" L?min)。c(C)=" 0.05mol/(" L?min)×5min=0.25mol/L。正确。C. 由于B物质的状态为固态,所以其浓度不会发生变化,因此不能用物质间的速率关系来表示。错误。?D.平衡时,容器内压强与开始时的压强比为容器内气体的物质的量的比。在开始时n(A)=4mol;当达到平衡时n(C)=n(D)= 0.05mol/( L?min)×2L×5min="0." 5mol.则n(A)=4mol-3×0. 5mol="2." 5mol.所以平衡时容器内气体的总物质的量为:2. 5mol+0.5mol+0.5mol="3." 5mol。故压强为原来的3. 5mol÷4mol="0.875." 故平衡时,容器内压强为原来的0.875倍。正确。
本题难度:一般
3、填空题 (6分)氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3- Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-
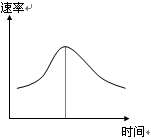
(1)反应开始时反应速率加快的原因是?;
(2)反应后期反应速率下降的原因是?。
参考答案:
(1)反应开始时c(H+)曾加,ClO3-的氧化性随c(H+)的增大而增强,化学反应速率加快;
(2)随着反应的进行,反应物的浓度降低化合反应速率减慢
本题解析:考查条件对反应速率的影响:浓度、温度、压强和催化剂等
(1)由题目所给信息可知,由于反应开始时生成了H+,ClO3-的氧化性随c(H+)的增大而增强,化学反应速率加快
(2)反应进行过程中,各反应物离子的浓度减小成为影响反应速率大小的主要因素,降低了反应速率
本题难度:简单
4、填空题 亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
_____Na2SO3+____KIO3+____ H2SO4=____Na2SO4 +_____K2SO4+____ I2 +_____H2O
(1)配平上面的氧化还原反应方程式,将化学计量数填在空白处。
(2)其中氧化剂是_______,若反应中有5mol电子转移,则生成碘_______mol。
(3)该反应过程和机理较复杂,一般认为分以下①~④步反应:
①IO3-+SO32- =IO2-+SO42- (反应速率慢)
②IO2-+2SO32- =I-+2SO42- (反应速率快)
③5I-+6H++IO3-=3I2+3H2O (反应速率快)
④I2+SO32- +H2O=2I-+SO42- +2H+ (反应速率快)
根据上述条件推测,此反应总的反应速率由__________步反应决定(填上述四步反应的序号)。
(4)若预先加入淀粉溶液,由题述看必须在___________离子消耗完时,才会有使淀粉变蓝的现象产生。
参考答案:(1)5 、2 、1 、5 、1 、1 、1
(2)KIO3? ;0.5
(3)①
(4) SO32-
本题解析:
本题难度:一般
5、选择题 下列条件下的反应,放出 最快的是:
最快的是:
?
| 金属(粉末状)/mol
| 酸的浓度和体积(mL)
| 反应温度
|
A
| Mg
| 0.1
| 3mol/LH2SO4
| 10
| 20℃
|
B
| Al
| 0.1
| 3mol/LHCl
| 10
| 20℃
|
C
| Zn
| 0.1
| 3mol/LCH3COOH
| 10
| 20℃
|
D
| Fe
| 0.1
| 6mol/LHNO3
| 10
| 20℃
参考答案:A
本题解析:略
本题难度:简单
|