| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《化学反应速率》考点强化练习(2020年押题版)(二)
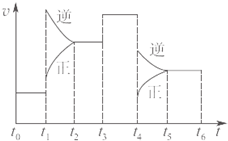 参考答案:分析图象可知,t2→t3是原平衡逆向移动后建立的平衡,SO3的百分含量降低,t3→t4和t2→t3两个时间段内,SO3的百分含量相同,t5→t6是平衡再次逆向移动后建立的平衡,SO3的百分含量再次降低,所以t0→t1时间段内达到的平衡状态下三氧化硫的百分含量最大, 本题解析: 本题难度:简单 5、实验题 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
  (1) 该实验探究的是?因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是?- ?(填实验序号)。 (2)若实验①在2 min末收集了4.48 mL CO2(标准状况下), 则在2 min末,c(MnO4-)=?mol/L。 (3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定?来比较化学反应速率。 (4)小组同学发现反应速率总是如右图,其中t1~t2时间内速?率变快的主要原因可能是:①该反应放热、②?。 参考答案:(1)浓度? ②>① 本题解析:(1)从题中可以看出H2C2O4溶液的浓度不同,KMnO4溶液而的浓度相同,说明该实验探究的是浓度对对化学反应速率的影响,并且浓度越大,反应速率越快,相同时间内针筒中所得CO2的体积为②>①;(2)中,在2 min末收集了4.48 mL CO2(标准状况下),即得到了0.0002mol CO2,根据2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知,消耗了0.00004mol MnO4-,则剩下的 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《胶体》考点.. | |