1、选择题 下列关于课本中的元素周期表的判断中正确的是? (? )
A.三个短周期都含有8种元素
B.三个长周期都含有18种元素
C.七个副族都含有4种元素
D.一个O族含有6种元素
2、填空题 (4分)碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲烷是最简单的有机物,实验室可通讨下列反应制取:
CH3COONa+NaOH CH4↑+X(已配平)
CH4↑+X(已配平)
X属于?晶体(填晶体类型)。
(2)金刚石和石墨是两种重要的碳单质。
①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有?个。
②石墨晶体能导电,导电的粒子是?。
(3)甲硅烷(SiH4)的结构与甲烷相似,甲硅烷能与硝酸银发生如下反应:
SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3该反应中氢元素被氧化,由此可判断电负性:Si?H(填“>”、“<”或“=”)
3、填空题 (13分)试根据下表填空:
A
| ?
| ?
|
?
| B
| ?
| ?
| C
| D
| E
| F
| ?
|
G
| H
| I
| J
| ?
| L
| K
| M
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| N
| ?
| ?
| Q
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | | |
|
(1)请写出元素Q的基态原子电子排布式?;元素N在周期表中的位置?周期?族。
(2)基态D原子核外有?个未成对电子;D2分子中分别有?个,?个π键。
(3)化合物DA5中既含离子键,又含共价键和配位键,请写出它的电子式??。
(4)表四中的元素能形成XY2型的共价分子有CE2、CL2、BK2、LE2四种,其分子的空间构型中有一种与其他三种不同,它是?(填化学式);而形成XY3型的共价分子也有四种,它们分别是DA3、DF3、DK3、LE3,其分子的空间构型中也有一种与其他三种不同,它是?(填化学式),它是由_?键(填“极性”或“非极性”,下同)构成的?分子。
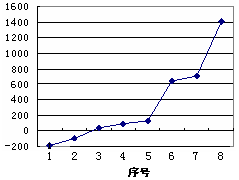
(5)第三周期8种元素按单质熔点高低的顺序如右图所示,其中序号“8”所代表的元素是?(填元素符号);其中气态氢化物稳定性最强的元素是?(填下图中的序号)。
(6)科学家证实,IK3属于共价化合物,分子式为I2K6,其结构式为下列四种中的一种,你认为正确的结构式是____________。

(7)向Q的硫酸盐溶液中加入足量的DA3的水溶液过程中,请写出发生反应的离子方程式?;最后生成配离子的结构式为?。
4、填空题 (1)A元素的负一价离子和B元素的正一价离子的电子层结构都与氩相同,A的离子结构示意图为?,B元素名称为?;
(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为?.
(3)D元素的原子序数为33,该元素原子的核外电子共有?种不同的运动状态,此元素原子的核外电子排布式是?
(4)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的?键更稳定(填“σ”或“π”)。
(5)下列4种物质熔、沸点由高到低排列为?(填序号).
①金刚石?②晶体锗?③晶体硅?④金刚砂
5、选择题 对原子核外电子以及电子的运动,下列描述正确的是(? )
①可以测定某一时刻电子所处的位置?②电子质量很小且带负电荷?③运动的空间范围很小?④高速运动?⑤有固定的运动轨道?⑥电子的质量约为氢原子质量的
A.①②③
B.②③④⑥
C.③④⑤⑥
D.⑤⑥