1、选择题 下列关于课本中的元素周期表的判断中正确的是? (? )
A.三个短周期都含有8种元素
B.三个长周期都含有18种元素
C.七个副族都含有4种元素
D.一个O族含有6种元素
参考答案:D
本题解析:考查元素周期表的结构。第一周期有2种元素,A不正确。第6周期含有32种元素。第ⅢB中含有镧系和锕系,元素不止4种。所以正确的答案是D。
本题难度:简单
2、填空题 (4分)碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲烷是最简单的有机物,实验室可通讨下列反应制取:
CH3COONa+NaOH CH4↑+X(已配平)
CH4↑+X(已配平)
X属于?晶体(填晶体类型)。
(2)金刚石和石墨是两种重要的碳单质。
①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有?个。
②石墨晶体能导电,导电的粒子是?。
(3)甲硅烷(SiH4)的结构与甲烷相似,甲硅烷能与硝酸银发生如下反应:
SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3该反应中氢元素被氧化,由此可判断电负性:Si?H(填“>”、“<”或“=”)
参考答案:(4分,每空一分)(1)离子 (2)①3?②自由电子(3)<
本题解析:(1)根据原子守恒可知,X应该是碳酸钠,属于离子晶体。
(2)①根据构造原理可知,基态Cr3+离子核外电子排布式是1s22s22p63s23p63d3,所以基态Cr3+离子中未成对电子数有3个。
②石墨晶体中含有自由电子,所以可以导电。
(3)根据反应的方程式可知,氢元素失去电子,被氧化。这说明SiH4中氢元素显负价,Si元素显正价,所以硅元素的大发展小于氢元素的。
点评:该题是高考中的常见题型,试题难易适中,注重基础和能力的双向考查。该题的难点在于(3)问,该题有利于培养学生的逻辑思维能力,以及灵活应变能力。
本题难度:一般
3、填空题 (13分)试根据下表填空:
A
| ?
| ?
|
?
| B
| ?
| ?
| C
| D
| E
| F
| ?
|
G
| H
| I
| J
| ?
| L
| K
| M
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| N
| ?
| ?
| Q
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | | |
|
(1)请写出元素Q的基态原子电子排布式?;元素N在周期表中的位置?周期?族。
(2)基态D原子核外有?个未成对电子;D2分子中分别有?个,?个π键。
(3)化合物DA5中既含离子键,又含共价键和配位键,请写出它的电子式??。
(4)表四中的元素能形成XY2型的共价分子有CE2、CL2、BK2、LE2四种,其分子的空间构型中有一种与其他三种不同,它是?(填化学式);而形成XY3型的共价分子也有四种,它们分别是DA3、DF3、DK3、LE3,其分子的空间构型中也有一种与其他三种不同,它是?(填化学式),它是由_?键(填“极性”或“非极性”,下同)构成的?分子。
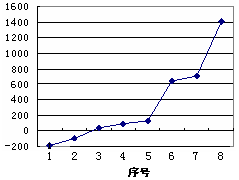
(5)第三周期8种元素按单质熔点高低的顺序如右图所示,其中序号“8”所代表的元素是?(填元素符号);其中气态氢化物稳定性最强的元素是?(填下图中的序号)。
(6)科学家证实,IK3属于共价化合物,分子式为I2K6,其结构式为下列四种中的一种,你认为正确的结构式是____________。

(7)向Q的硫酸盐溶液中加入足量的DA3的水溶液过程中,请写出发生反应的离子方程式?;最后生成配离子的结构式为?。
参考答案:(1)(2分)1s22s22p63s23p63d104s1;?第4周期? VIII族。
(2) 3;?1?, ?2。
(3)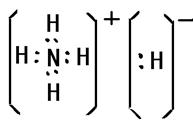
(4)? SO2;? SO3?;?极性;?非极性
(5) Si 、 2 ;(6) ③ 。(7)Cu2++2NH3?H2O= Cu(OH)2↓+2NH4+?
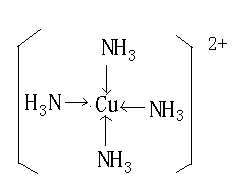
Cu(OH)2 +4NH3 =〔Cu(NH3)4〕2+? + 2OH-。
本题解析:根据所给的部分周期表可以确定元素分别是:A:? H? B: Be? C:? C? D: N? E: O? F:? F? G:? Na? H:? Mg? I: Al?J: Si? K: Cl? L: S? M:? Ar? N:Fe? Q: Cu
出元素Q即铜的基态原子电子排布式1s22s22p63s23p63d104s1;元素N即铁在周期表中的位置四周期VIII族;基态D即氮原子核外有3个未成对电子;D2分子中分别有1个,2个π键;化合物DA5即NH5是离子化合物其中既含离子键,又含共价键和配位键,它的电子式是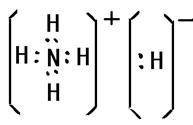
;表四中的元素能形成XY2型的共价分子有CE2即二氧化碳、CL2二硫化碳、BK2即氯化铍、LE2即二氧化硫四种,其分子的空间构型中有一种与其他三种不同,它是SO2;而形成XY3型的共价分子也有四种,它们分别是DA3即氨气、DF3即三氟化氮、DK3即三氯化氮、LE3即三氧 化硫,其分子的空间构型中也有一种与其他三种不同,它是SO3,它是由极性键构成的非极性键分子;第三周期8种元素按单质熔点高低的顺序如右图所示,其中序号“8”所代表的元素是Si ,?其中气态氢化物稳定性最强即非金属性最强的元素是2;科学家证实,IK3即氯化铝属于共价化合物,分子式为Al2Cl6,会形成配位键,所以其结构式是?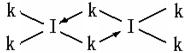
;向Q即铜的硫酸盐即硫酸铜溶液中加入足量的DA3的水溶液即氨水的过程中,请写出发生反应的离子方程式Cu2++2NH3?H2O= Cu(OH)2↓+2NH4+;Cu(OH)2 +4NH3 =〔Cu(NH3)4〕2+? + 2OH-。
最后生成配离子的结构式为 。
。
点评:对于此类题目,要求学生对元素周期表一定要熟悉,能根据元素的位置关系准确找出元素。
本题难度:一般
4、填空题 (1)A元素的负一价离子和B元素的正一价离子的电子层结构都与氩相同,A的离子结构示意图为?,B元素名称为?;
(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,C的元素基态原子的外围电子排布式为?.
(3)D元素的原子序数为33,该元素原子的核外电子共有?种不同的运动状态,此元素原子的核外电子排布式是?
(4)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的?键更稳定(填“σ”或“π”)。
(5)下列4种物质熔、沸点由高到低排列为?(填序号).
①金刚石?②晶体锗?③晶体硅?④金刚砂
参考答案:(每空2分)(1)  ,钾;(2)3d104s1?(3)? 33 ;【Ar】3d104s24p3
,钾;(2)3d104s1?(3)? 33 ;【Ar】3d104s24p3
(4)π? (5)?①>④>③>②
本题解析:(1)A元素的负一价离子和B元素的正一价离子的电子层结构都与氩相同,则A和B分别是氯元素和钾元素,则A的离子结构示意图为 。
。
(2)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,所以C应该是铜元素,则根据构造原理可知,C的元素基态原子的外围电子排布式为3d104s1。
(3)D元素的原子序数为33,该元素原子的核外电子共有33种不同的运动状态。则根据构造原理可知,此元素原子的核外电子排布式是【Ar】3d104s24p3。
(4)氮气分子中的三键是由1个σ键和2个π键构成的,则π键键能是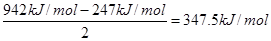 >247kJ/mol,所以π键比σ键稳定。
>247kJ/mol,所以π键比σ键稳定。
(5)四种物质形成的晶体都是原子晶体,原子晶体中原子半径越小,共价键越强,晶体的熔沸点越高。由于原子半径是C<Si<Ge,所以4种物质熔、沸点由高到低排列为①>④>③>②。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,试题在注重对基础知识巩固和训练的同时,更侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
5、选择题 对原子核外电子以及电子的运动,下列描述正确的是(? )
①可以测定某一时刻电子所处的位置?②电子质量很小且带负电荷?③运动的空间范围很小?④高速运动?⑤有固定的运动轨道?⑥电子的质量约为氢原子质量的
A.①②③
B.②③④⑥
C.③④⑤⑥
D.⑤⑥
参考答案:B
本题解析:原子核外电子的运动规律不同于宏观物体的运动规律,不能测定某一时刻电子所在的位置,也没有固定的运动轨迹,只是在原子核周围的一定区域范围内高速运动,电子的质量很小,只有质子质量的 。
。
本题难度:简单