1、选择题 用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨。已知铅蓄电池的总反应为:
Pb(s)+PbO2(s)+ 2H2SO4( aq) 2PbSO4(s) +2H2O(1),通电时a电极质量增加,下列说法正确的是
2PbSO4(s) +2H2O(1),通电时a电极质量增加,下列说法正确的是

[? ]
A.电路中通过1 mol电子时,Y电极质量增加48 g
B.放电时铅蓄电池负极的电极反应式为:PbO2(s) +4H+ (aq)+SO42- (aq)+4e-==PbSO4 (s)+ 2H2O(1)
C.c、d电极产生气体的物质的量之比为1:2
D.X极为负极
2、填空题 某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
【实验1】:如图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细.电解开始
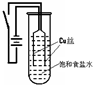
30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色.
【实验2】:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
| 序号 | 操作 | 现象
①
滴入稀硝酸溶液
沉淀溶解,有无色气泡产生,最终得到蓝色溶液.
②
滴入稀硫酸溶液
橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色
|
阅读资料:常见铜的化合物颜色如下:
| 物质 | 颜色 | 物质 | 颜色
氯化铜
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色
氢氧化亚铜(不稳定)
橙黄色
碱式氯化铜
绿色
氢氧化铜
蓝色
氧化亚铜
砖红色或橙黄色
氯化亚铜
白色
|
请回答下列问题:(1)铜的常见正化合价为______,最终试管底部橙黄色沉淀的化学式______;
(2)阳极上发生的反应为:______;
(3)写出实验2中①、②的离子方程式①______②______.
3、填空题 【选修2—化学与技术】(14分)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
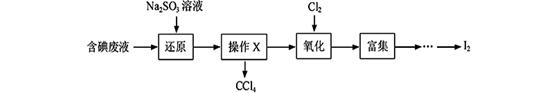
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ; ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。(1分)
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。

(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
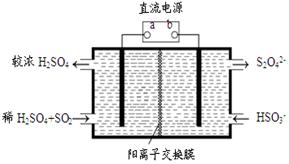
①阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为 。
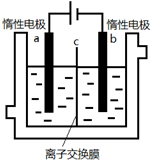
4、选择题 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法正确的是( )
A.a电极是阴极
B.a极区的KI最终转变为KIO3
C.阳极电极反应:4OH--4e-═2H2O+O2↑
D.电解过程中OH-从a极区通过离子交换膜c进入b极区