1、填空题 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤:
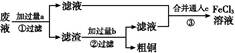
写出一个能证明还原性Fe比Cu强的离子方程式: 。
该反应在上图步骤 中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。
上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及主要的电极反应式 。
2、选择题 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理图所示。下列说法不正确的是:
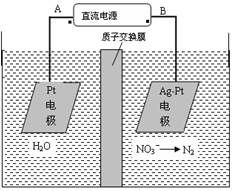
A.A为电源正极
B.阳极反应式为:2H2O-4e-=4H++O2↑
C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为10.4克
D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-
3、选择题 下图两个装置中溶液体积均为200mL,工作前电解质溶液的浓度均为0. 5mol/L,工作一段时间后,测得均有0.02mol电子通过。若忽略溶液体积的变化,下列叙述正确的是

[? ]
A.产生气体体积①=②
B.①中阴极质量增加,②中正极质量减小
C.溶液的pH变化:①减小,②增大
D.电极反应式:①中阳极:4OH-=2H2O+O2↑+4e-,②中负极:2H++2e-=H2↑
4、选择题 取一定体积、由等物质的量浓度的硫酸铜、硫酸铁组成的溶液,用石墨电极进行电解,电解时,阴极最先发生的反应为( )
A.Fe3++eˉ=Fe2+
B.2H++2eˉ=H2↑
C.Fe2++2eˉ=Fe
D.Cu2++2eˉ=Cu
5、填空题 (15分)甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景。工业上可用如下方法合成甲醇:
方法一
| CO(g) +2H2(g)  CH3OH(g) CH3OH(g)
|
方法二
| CO2(g) +3H2(g)  CH3OH(g) H2O(g) CH3OH(g) H2O(g)
|
(1)已知:① 2CH3OH(l) + 3O2(g)  2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1
2CO2(g) + 4H2O(g) △H=-1275.6 kJ?mol-1
② 2CO(g) + O2(g)  2CO2(g) △H=-566.0 kJ?mol-1
2CO2(g) △H=-566.0 kJ?mol-1
③ H2O(l) = H2O(g) △H =" +" 44.0 kJ?mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为 。
(2)方法一生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%。请回答下列问题:
①前5分钟内甲醇的平均反应速率为 ;已知该反应在低温下能自发进行,则反应的
△H为 (填“>”、“<”或 “=”)0。
②在该温度下反应的平衡常数K= 。
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,将使ν正 ν逆(填“>”“=”“<”)。
(3)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
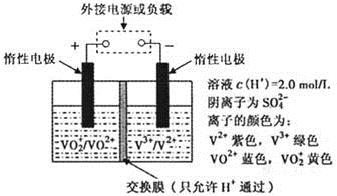
①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色变化是 。
③若用甲醇燃料电池作为电源对其充电时,若消耗甲醇4.8g时,电路中转移的电量的为 (法拉第常数F=9.65×l04C · mol-1)。