1、选择题 有关“物质和结构”研究方法的表述错误的是
[? ]
A.价层电子对互斥理论不能预测所有分子的立体结构
B.杂化轨道理论是鲍林为了解释分子的立体结构提出来的
C.金属和非金属、无机物和有机物之间并没有严格的界限,分类的研究方法不科学
D.规律是对经常出现的客观现象的归纳,对例外的深入探究是科学发展的内在动力
参考答案:C
本题解析:
本题难度:简单
2、简答题 (1)下列分子中,属于平面型构型的有______.
A.CCl4 B.PH3 C.BBr3 D.COCl2
(2)H2O分子间因存在“氢键”的作用而彼此结合形成(H2O)n.在该分子形成的晶体中每个H2O分子被4个H2O分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如图甲所示.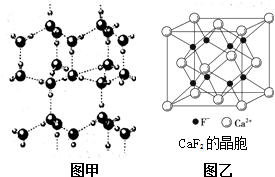
请回答下列问题:
①含1mol H2O的该晶体中有______个“氢键”.
②请说明H2O比H2S的沸点高的原因______.
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子的价电子排布式为______;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为______;该晶体中,原子之间的作用力是______.
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构CaF2的结构(如图乙)相似,该晶体储氢后的化学式应为______.
参考答案:(1)A.CCl4 分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+12(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,故A错误;
B.PH3中中心原子价层电子对个数=5+1×32=4,磷原子SP3杂化,轨道构型为四面体,成键原子有3个,分子空间构型为三角锥形,故B错误;
C.BBr3中中心原子价层电子对个数=3+1×32=3,硼原子SP2杂化,轨道构型为平面三角形,成键原子有3个,分子空间构型为平面三角形,故C正确;
D.,故D正确.
故答案为:CD;
(2)①该分子形成的晶体中每个H2O分子通过氢键与4个H2O分子理解,每个氢键为H2O分子提供12,所以含1molH2O的该晶体中有 1mol×4×12=2mol“氢键”,故答案为:2NA;
②H2O中存在氢键,常温下为液体,所以沸点H2O>H2S,故答案为H2O分子之间存在氢键作用:
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则价电子排布式为5d106s1,在晶胞中Cu原子处于面心,N(Cu)=6×12=3,Au原子处于顶点位置,N(Au)=8×18=1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键键合力,故答案为:5d106s1;3:1;金属键;
(4)CaF2的结构如图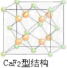 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,故答案为:Cu3AuH8.
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,故答案为:Cu3AuH8.
本题解析:
本题难度:一般
3、填空题 (7分))如图是氯化钠的晶胞示意图,回答如下问题:
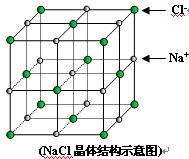
(1)在NaCl晶体中,与每个Cl-距离等同且距离最近的几个Na+所围成的空间几何构型为__________。
A.正四面体? B.正六面体? C.正八面体? D.正十二面体
(2)NaCl晶体中不存在分子,但是当温度达到1686 K时,NaCl晶体形成气体,并以分子形式存在。现有29.25 g NaCl晶体,强热使其气化,测的气体体积为5.6 L(已折算成标准状况)则此时氯化钠气体的化学式为_____________。
(3)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl细粒干燥后,准确称取a g NaCl固体并转移到定容容器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积为V cm3。步骤①中A仪器最好使用_______________。
A.量筒? B.烧杯? C.容量瓶? D.试管
(4)已知NaCl晶体中,距离最近的Na+与Cl-间的平均距离为b cm,用上述测定方法测得的阿伏加德罗常数NA的表达式为______________________。(用含V、a、b的代数式表示)
参考答案:(1)C(1分)?(2) (NaCl)2(写成Na2Cl2也可以)(3)C?(4) 58.5V/(2ab3)每空2分
本题解析:略
本题难度:简单
4、选择题 下列化学式能真实表示物质分子组成的是?(?)?
①NaOH?②SiO2?③SO3?④He?⑤P ⑥Na2O2
A.②③⑤
B.③⑤
C.③④
D.③④⑤
参考答案:C
本题解析:在离子晶体和原子晶体中不存在分子,所以其化学式不能代表物质的分子组成。只有在分子晶体中才存在分子,其化学式代表物质的分子组成。因为磷有多种同素异形体,所以⑤也不能代表物质的分子组成。答案是C。
本题难度:简单
5、选择题 金刚石是典型的原子晶体,下列关于金刚石的说法中错误的是(? )
A.晶体中不存在独立的“分子”
B.碳原子间以共价键相结合
C.是硬度最大的物质之一
D.化学性质稳定,即使在高温下也不会与氧气发生反应
参考答案:D
本题解析:金刚石化学性质稳定,但在高温下也会与氧气发生反应,选项D不正确,其余选项都是正确的,答案选D。
点评:该题主要是考查学生对金刚石结构和性质的熟悉了解程度,意在巩固学生的基础,提高学生的能力。
本题难度:一般