1、选择题 根据下表信息,下列叙述中正确的是
序号
| 氧化剂
| 还原剂
| 其他反应物
| 氧化产物
| 还原产物
|
①
| C12
| FeBr2
| ?
| ?
| Cl-
|
②
| KMnO4
| H2O2
| H2SO4
| O2
| Mn2+
|
③
| KClO3
| 浓盐酸
| ?
| Cl2
| C12
|
④
| KMnO4
| 浓盐酸
| ?
| Cl2
| Mn2+
|
? A、表中①组反应的氧化产物一定只有FeCl3
B、氧化性强弱比较:KMnO4>C12>Fe3+>Fe2+
C、还原性强弱比较:H2O2>Mn2+>Cl-
D、③反应中的浓盐酸即起还原剂作用又起酸的作用
参考答案:BD
本题解析:A选项中C12如果在过量情况下可以将+2价铁与-1价溴全部氧化。B选项中可以通过化学方程式中氧化剂氧化性大于氧化产物来进行判断,结果正确。C选项从第四个反应中可得出,还原剂还原性大于还原产物,所以有Cl->Mn2+。D选项正确。
本题难度:一般
2、选择题 化学概念在逻辑上存在如下关系:对下列概念的说法正确的是
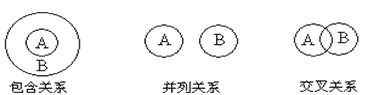
[? ]
A.纯净物与混合物属于包含关系
B.化合物与碱性氧化物属于包含关系
C.单质与化合物属于交叉关系
D.氧化还原反应与分解反应属于并列关系
参考答案:B
本题解析:
本题难度:简单
3、选择题 根据表中信息判断,下列选项不正确的是
序号
| 反应物
| 产物
|
①
| KMnO4、H2O2、H2SO4
| K2SO4、MnSO4…
|
②
| Cl2、FeBr2
| FeCl3、FeBr3
|
③
| MnO4-…
| Cl2、Mn2+…
|
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
参考答案:D
本题解析:第①组发生的化学方程式为2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+8H2O+5O2; 第②组发生的方程式为3Cl2+6FeBr2?=2FeCl3+4FeBr3 ;第③组2Cl-→Cl2,生成1mol氯气时转移2mol电子;D项氧化性Fe3+<Br2,错误。
本题难度:一般
4、选择题 下列基本类型的化学反应中,一定属于氧化还原反应的是
[? ]
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
参考答案:C
本题解析:
本题难度:简单
5、实验题 二氧化氮(NO2)是一种具有高度活性的气态物质,NO2与Na2O2均具有较强的氧化性,某研究性学习小组对二者能否发生反应进行探究。
【实验】
下列关于实验室制备NO2的说法正确的是_______
a.实验室常用铜和浓硝酸反应制取二氧化氮
b.二氧化氮常用向下排空气法收集
c.二氧化氮易溶于水,尾气可用水吸收.
d.用注射器收集的二氧化氮,压缩后颜色变浅
e.实验后容器中残留液需用碱液处理
【提出假设】
假设一:NO2与Na2O2二者不反应;
假设二:NO2能被Na2O2氧化;
假设三:?
【查阅文献】
NO2在反应中能生成HNO3和HNO2;HNO2旣有氧化性,又有还原性,能被强氧化剂如KMnO4氧化。
【设计实验】
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设?不成立。
(2)若假设二成立,反应的化学方程式是?。
(3)为验证假设二是否成立,该小组同学做了如下定性实验研究,请完成下表内容。
实验步骤
(不要求写具体操作过程,仪器任选)
| 预期的实验现象及结论
|
取适量的白色固体置于试管中,…………
| ?
|
?
【定量分析】
若实验前该小组同学用托盘天平称量过氧化钠的质量为3.9g,充分反应后白色固体质量为8.4g,该小组同学得出假设2不成立的结论。你是否同意他们的结论,并简述理由:?
参考答案:(共13分)
【实验】a e(2分)?
【提出假设】假设三:NO2能被Na2O2还原(2分)
【设计实验】 (1)一(1分)
(2)2NO2 + Na2O2 = 2NaNO3(2分,不配平不得分)
(3)(4分)
实验步骤(不要求写具体操作过程)
预期的实验现象及结论
取适量的白色固体置于试管中,加蒸馏水溶解,再滴加稀硫酸酸化,最后滴加高锰酸钾溶液。
若高锰酸钾溶液不褪色,则假设2成立;若高锰酸钾溶液褪色,则假设2不成立。(其他合理答案也可)
?
(4)(2分)不同意。若3.9 g过氧化钠全部氧化二氧化氮,生成NaNO3的质量应该为8.5 g,而现在测量的质量为8.4 g,质量相差不大,在托盘天平称量的误差范围之内,这完全有可能为实验误差引起。
(同意。若3.9 g过氧化钠全部氧化二氧化氮,生成的NaNO3的质量应该为8.5 g,而现在测量的质量为8.4 g<8.5 g。注:本题为开放性答案,其它合理答案也可)
本题解析:
【实验】考查NO2的制备,a、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,正确;b、NO2能与水发生反应,故不能使用排水法收集,错误;c、溶于水后生成NO,同样是污染,错误;d、压缩后虽有部分转化为N2O4,但NO2的浓度增大,颜色加深,错误;e、残液为酸性,故用碱处理,正确。
【提出假设】根据情况,不反应、反应被氧化,另外为反应被还原;
【设计实验】
(1)用淡黄色变为白色,说明过氧化钠反应,假设一错误
(2)假设二成立,NO2被Na2O2氧化,即氮的化合价升高从+4到+5,O从- 91eXaM.org1到-2,然后配平即得到答案。
(3)关键是对产物的检验,硝酸根的检验方法。
本题难度:一般