1、选择题 已知在热的碱性溶液中,NaClO发生如下反应:3NaClO=2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
[? ]
A.NaCl、NaClO
B.NaCl、NaClO3
C.NaClO、NaClO3
D.NaClO3、NaClO4
参考答案:B
本题解析:
本题难度:简单
2、选择题 设 NA表示阿伏加德罗常数,下列说法不正确的是
A.常温常压下,11.2 L氧气所含的原子数为NA
B.1.8 g 的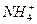 中含有的电子数为NA
中含有的电子数为NA
C.常温常压下,48 g O3含有的氧原子数为3NA
D.2.4 g金属镁变为镁离子时失去的电子数为0.1NA
参考答案:BC
本题解析:常温常压下,11.2 L氧气(O2)的物质的量小于0.5 mol,则所含的原子数小于NA;1.8 g的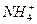 的物质的量为0.1 mol,所含电子数为0.1 mol×10×NA,即 NA个; 48 g O3含有氧原子的物质的量为
的物质的量为0.1 mol,所含电子数为0.1 mol×10×NA,即 NA个; 48 g O3含有氧原子的物质的量为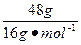 ="3" mol,所以含有的氧原子的数目为3NA;2.4 g金属镁失去电子的数目为0.1 mol×2×NA mol-1=0.2NA。
="3" mol,所以含有的氧原子的数目为3NA;2.4 g金属镁失去电子的数目为0.1 mol×2×NA mol-1=0.2NA。
本题难度:简单
3、填空题 (10分)下图所涉及的物质中,C、D、E均为单质, 且E为日常生活中常见金属,其余均?为化合物
且E为日常生活中常见金属,其余均?为化合物 。它们之间的转化关系如图所示(反应中生成的水及次要产物均已略去)。
。它们之间的转化关系如图所示(反应中生成的水及次要产物均已略去)。

请回答:
(1)写出有关物质的化学式
A?,F?,H?。
(2)指出MnO2在相关反应中的作用:反应①中是?剂,反应②中是?剂。
(3)若反应①是在加热条件下进行,则A是?(填化学式)。
(4)写出反应②的化学方程式?。
(5)向G中加入NaOH溶液,观察到的现象为?。
参考答案:(1)H2O2?,Fe3O4?,? FeCl3(各1分)
(2)催化?,氧化 (各1分)
△
本题解析:略
本题难度:一般
4、实验题 某兴趣小组设计并进行了以下实验来制取氯水,并利新制用氯水完成实验。
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。

(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。
参考答案:(1)H→B、A→C、D→E (2分)饱和食盐水(2分)
(2)2NaCl + MnO2 +2 H2SO4 = MnSO4 + Na2SO4 + 2H2O + Cl2↑(加热) (2分)
(3)①BaCl2(1分) KOH (1分)
②足量的新制氯水 (2分)
(4)①SCN-(1分)
②HNO3过量,没有Fe2+剩余 (1分)
③NO2、CO2、N2(3分)
④少量(1分)
本题解析:
试题分析: (1)制备气体的仪器连接遵从发生装置→除杂装置→干燥装置→收集→尾气吸收的顺序,考虑制备氯气中含有HCl和水蒸气等杂质气体,所以先用排饱和食盐水法除去HCl,再用浓硫酸吸收水蒸气,再用向上排空气法收集,用碱吸收尾气,满足该顺序,连接应为H→B、A→C、D→E,所以根据顺序可以得知广口瓶Ⅱ中的试剂为饱和食盐水。
(2)根据图中的发生装置可知,该实验中采用了难挥发的硫酸制备挥发性的盐酸,再与二氧化锰制备氯气的方法,所以方程式为2NaCl + MnO2 +2 H2SO4 = MnSO4 + Na2SO4 + 2H2O + Cl2↑(加热)。
(3)①氯化钾中含有Fe3+、SO42-、Br-等杂质离子,其中加入的试剂是NH3.H2O可以使Fe3+ 沉淀除去,除去SO42- 需要加入Ba2+试剂,使之转化为BaSO4沉淀除去,为了不引入过多杂质,应选用阴离子相同的BaCl2 ;为了把NH4+除去,可以加入强碱KOH,所以步骤a中依次加入的试剂是NH3.H2O、 BaCl2 、KOH。②步骤c中除去的是杂质Br- ,所以加入新制氯水,把Br- 转化为单质Br2除去。
(4)①甲同学已经假设是FeSO4与HNO3作用 ,所以根据提供的资料可以猜测导致实验现象的可能是SCN-和硝酸作用的结果,所以乙同学假设是SCN-与HNO3作用。
②如果按照甲同学的假设分析,FeSO4与HNO3作用只会导致Fe2+被氧化为Fe3+最终和KSCN作用使溶液变红,且加入的浓HNO3过量,不会出现溶液显红色后又变成蓝色,所以甲同学假设不成立。
③根据乙同学的假设,造成实验现象的是浓HNO3和KSCN溶液作用的结果。根据物质中的元素组成分析,浓硝酸生成红棕色气体NO2,SCN-中产生的能使Ba(OH)2溶液产生浑浊现象的气体不可能是SO2,因为SO2容易被强氧化剂氧化,所以只可能是CO2,而S被氧化为SO42-在反应后的溶液中,所以加入BaCl2溶液能产生白色沉淀;剩余的空气主要成分的气体是N2,所以产生的气体依次是NO2、CO2、N2 。
④用SCN-间接检验Fe2+时,需要加入强氧化剂把Fe2+氧化才会出现无色变红色现象,但是根据上述中的实验经历,如果强氧化剂过量容易把用SCN-氧化,使溶液红色消失变成蓝色。根据资料提供显示氧化性Cl2 >(SCN)2?,所以氯气过量同样能氧化SCN- ,造成红色消失变成蓝色的现象,所以加入氧化剂的量必须要少量。
本题难度:一般
5、选择题 下列与有关非金属元素叙述以及推理结果不正确的是(?)
①非金属性F>Cl,故将F2通入NaCl溶液中,发生反应为:F2 + 2Cl-= Cl 2 + 2F-?
②非金属性F>Br,故酸性:HF>HBr?
③非金属性S>As ,故前者的气态氢化物稳定性更强
④非金属性O>N,故O 2与H2化合比N2更容易
A.②③
B.③④
C.①④
D.①②
参考答案:D
本题解析:①错误,非金属性F>Cl,将F2通入NaCl溶液,发生与水的反应,即
2F2+2H20=4HF+O2↑;②错误,非金属性F>Br,酸性为HBr> HF,③④的叙述是正确的,所以本题的答案为D。
点评:本题考查了元素的非金属性,本题有一定的综合性,其命题方式是高考命题的热点,本题难度适中,注意要看清楚题目要选择的是推理结果不正确的。
本题难度:简单