1、选择题 下列溶液中氯离子的物质的量浓度与50 mL 1 mol·L-1氯化铝溶液中氯离子的物质的量浓度相等的是(?)
A.150 mL 1 mol·L-1 NaCl溶液
B.75 mL 1.5 mol·L-1FeCl3溶液
C.150 mL 3 mol·L-1 KCl溶液
D.50 mL 3 mol·L-1MgCl2溶液
参考答案:C
本题解析:50mL1mol?L-1AlCl3溶液中氯离子的物质的量浓度为1mol?L-1×3=3mol?L-1,A、150mL1mol?L-1NaCl溶液中Cl-浓度为1mol?L-1×1=1mol?L-1,错误;B、75mL1.5mol?L-1FeCl3溶液中Cl-浓度为1.5mol?L-1×3=4.5mol?L-1,错误;C、150?mL?3?mol?L-1KCl溶液中Cl-浓度为3mol?L-1×1=3mol?L-1,正确;D、50mL3mol?L-1MgCl2溶液中Cl-浓度为3mol?L-1×2=6mol?L-1,错误;
本题难度:一般
2、选择题 阿伏加德罗常数的值约为6.02×1023mol-1,下列叙述中不正确的是
①12.4g白磷晶体中含有的P-P键数约是0.6×6.02×1023?
②电解精炼铜时转移了6.02×1023个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1×6.02×1023
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2×6.02×1023
⑤2.9g 2CaSO4·H2O含有的结晶水分子数为0.02×6.02×1023?(2CaSO4·H2O式量为290)
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
A.①④⑥
B.①③④⑤⑥
C.②③⑤⑥
D.③④⑤⑥
参考答案:C
本题解析:略
本题难度:简单
3、计算题 (8分)使一定量Zn与100 ml 18.5 mol/L浓H2SO4充分反应,Zn完全溶解,同时生成标准状况下气体33.6L。将反应后溶液稀释至1L,测得其c(H+) = 0.1mol/L。求:
(1)生成气体的成分为:?;
(2)Zn的质量为??g;
(3)开始生成H2时H2SO4的浓度为?mol/L。(假设溶液体积无变化)
参考答案:(1) SO2,H2(2分? (2) 97.5(3分)? (3) 12.5(3分)
本题解析:考查根据化学反应方程式进行的有关计算。浓硫酸属于氧化性酸,和锌反应生成SO2。但随着反应的进行,硫酸的浓度会逐渐降低,当浓度降低到一定程度后,就变成稀硫酸。稀硫酸和锌反应生成的是氢气,即33.6L气体是SO2和氢气的混合气。反应前硫酸的物质的量是0.1L×18.5mol/L=1.85mol,反应后硫酸的物质的量是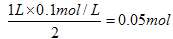 ,所以参加反应的硫酸是1.85mol-0.05mol=1.8mol。33.6L气体的物质的量是1.5mol,设混合气中SO2和氢气的物质的量分别是x和y,则根据反应式可知
,所以参加反应的硫酸是1.85mol-0.05mol=1.8mol。33.6L气体的物质的量是1.5mol,设混合气中SO2和氢气的物质的量分别是x和y,则根据反应式可知
Zn+2H2SO4(浓)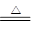 ZnSO4+2H2O+SO2↑?、? Zn+H2SO4=ZnSO4+H2↑
ZnSO4+2H2O+SO2↑?、? Zn+H2SO4=ZnSO4+H2↑
1mol? 2mol? 1mol? 1mol? 1mol? 1mol
X? 2x?x? y? y? y
所以有x+y=1.5mol和2x+y=1.8mol
解得x=0.3mol? y=1.2mol
所以锌的质量是(x+y)×65g/mol=97.5g
当开始生成氢气时溶液中的硫酸是1.85mol-2x=1.25mol
所以浓度是12.5mol/L
本题难度:一般
4、选择题 设NA代表阿伏加德罗常数,下列说法正确的是?
A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
B.2.4g金属镁变为镁离子时失去的电子数为0.2NA
C.H2SO4的摩尔质量是98 g/mol
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA
个数为1 NA
参考答案:BC
本题解析:略
本题难度:简单
5、选择题 下列溶液中,Na+ 数目最多的是(? )
A.1mol/L Na2SO4溶液200mL
B.0.9mol/L Na3PO4溶液200mL
C.2.5mol/L NaOH 溶液100mL
D.1mol/L NaHCO3溶液300mL
参考答案:B
本题解析:1mol/L Na2SO4溶液200mL,n(Na+)为0.4mol;0.9mol/L Na3PO4溶液200mL ,n(Na+)为0.54mol;2.5mol/L NaOH 溶液100mL,n(Na+)为0.25mol;1mol/L NaHCO3溶液300mL,n(Na+)为0.3mol。所以B项中Na+的数目最多。答案选B。
考点;物质的量计算
点评:本题根据n=cV来计算。
本题难度:简单