1、选择题 A2、B2、C23种单质和它们离子间能发生下列反应:2A-+C2=2C-+A2,2C-+B2=2B-+C2,若X-能与C2发生反应:2X-+C2=2C-+X2.下列说法中不正确的是( )
A.氧化性:B2>C2>A2
B.还原性:X->C->B-
C.X2与B-能发生
D.X2与B-不能发生
2、简答题 I.某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如图1:
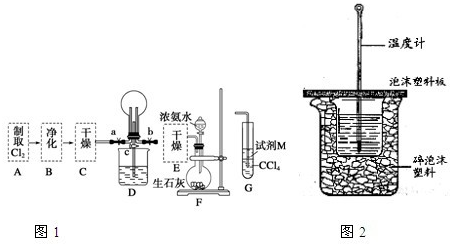
①利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管).请写出A中发生反应的离子方程式______,试剂M为______溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是______.
②已知3Cl2+2NH3═6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为______,反应一段时间后,关闭b打开c,观察到的现象为______.
II.用如图2所示装置进行中和热测定实验,请回答下列问题:
①从实验装置上看,图中缺少的一种玻璃仪器是______.
②使用补全仪器后的装置进行实验,取50mL?0.30mol/L?H2SO4溶液与50mL?0.65mol/L?NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高4.0℃.近似认为0.65mol/L?NaOH溶液和0.30mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g?℃).通过计算可得中和热△H=______,
③实验中若用60mL0.30mol?L-1H2SO4溶液跟50mL0.65mol?L-1NaOH溶液进行反应,与上述实验相比,所求中和热______ (填“相等”、“不相等”);若用50mL0.60mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会______ (填“偏大”、“偏小”、“不受影响”).
3、选择题 常温下,在水溶液中发生如下反应:①16H++10C-+2XO4-=2X2++5C2+8H2O;②2A2++B2=2A3++2B-;③2B-+C2=B2+2C-.下列说法错误的是( )
A.反应C2+2A2+=2A3++2C-可以进行
B.反应③是置换反应
C.氧化性由强到弱的顺序是XO4->C2>B2>A3+
D.还原性由强到弱的顺序是C->A2+>B->X2+
4、选择题 根据下列反应:(1)2Fe3++2I-=2Fe2++I2(2)Br2+2Fe2+=2Br-+2Fe3+判断离子的还原性由强到弱的顺序是(?)
A.Br->Fe2+>I-
B.I->Fe2+>Br--
C.Br->I->Fe2+
D.Fe2+>I->Br-
5、选择题 已知氧化还原反应发生的条件是:氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物。又已知还原性强弱顺序是I->Br—>Fe2+>Cl-(氧化性Cl2>Fe3+>Br2>I2),下列反应的化学方程式或叙述不成立的是
A.Br2+2HI =" I2+2HBr"
B.2FeCl2+Cl2="2FeCl3"
C.2FeCl2+2HCl+I2="2FeCl3+2HI"
D.Cl2通入到NaBr和NaI的混合溶液中:Cl2优先氧化I-