1、选择题 下列事实不能证明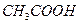 是弱酸的是(?)
是弱酸的是(?)
A.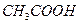 溶液能使石蕊溶液变红
溶液能使石蕊溶液变红
B.0.1 mol/L的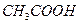 ,H+浓度为0.01mol/L
,H+浓度为0.01mol/L
C.等物质的量浓度的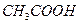 导电能力比盐酸弱
导电能力比盐酸弱
D.0.01mol/L的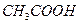 溶液中有两种分子存在
溶液中有两种分子存在
参考答案:A
本题解析:略
本题难度:简单
2、选择题 室温下有下列四种溶液:①0.1 mol/L氨水?②0.1 mol/L NH4Cl溶液?③混合溶液:盐酸和NH4Cl的浓度均为0.1 mol/L?④混合溶液:NaOH和氨水的浓度均为0.1 mol/L。四种溶液中c(NH4+)由大到小排列正确的是
A.②③④①
B.②①③④
C.③②④①
D.③②①④
参考答案:D
本题解析:氨水是弱碱,存在电离平衡;氯化铵是强电解质,完全电离,但氯化铵水解显酸性;盐酸的存在能抑制氯化铵水解;氢氧化钠的存在,能抑制氨水的电离,所以答案选D。
本题难度:一般
3、填空题 (Ⅰ)(9分)
现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜?⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)现有下列电解质溶液:①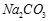 ?②
?②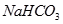 ?③
?③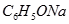 ?④
?④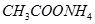 ?⑤
?⑤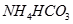 ?(已知酸性
?(已知酸性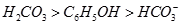 。)
。)
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号)?。
(2)常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填序号)?>?>?。
(3)写出⑤与足量NaOH溶液混合加热时反应的离子方程式?。
参考答案:(Ⅰ)⑤⑦⑧;③;②;(每空1分)
(Ⅱ)(1)②④⑤?(2)①>③>②(每空2分)
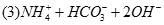

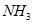 ↑
↑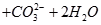
本题解析:本题考查电解质、强弱电解质概念,可以从物质分类的角度来看,强电解质为活泼金属氧化物、强酸、强碱和大多数盐,弱电解质为弱酸、弱碱和水,非电解质非金属氧化物、大多数非金属氧化物。电解质在熔融或水溶液中电离出阴阳离子,能够导电。
本题难度:一般
4、选择题 常温下,0.1 mol·L-1 HX溶液的pH=1,0.1 mol·L-1 CH3COOH溶液的pH=2.9。下列说法不正确的是?( )。
A.HX和CH3COOH均可抑制水的电离
B.取HCl与HX各0.1 mol溶于水配制成1 L混合溶液,则溶液的c(H+)=0.2 mol·L-1
C.等物质的量浓度、等体积的HX溶液与CH3COONa溶液混合后所得的溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.向等物质的量浓度、等体积的HX溶液和CH3COOH溶液中,分别加入一定物质的量浓度的NaOH溶液,欲使两者的pH均等于7,则消耗氢氧化钠溶液的体积:前者大于后者
参考答案:C
本题解析:由于0.1? mol·L-1 HX溶液的pH=1,所以HX完全电离,即HX为强酸;0.1 mol·L-1 CH3COOH溶液的pH=2.9,醋酸为弱酸。HX和CH3COOH电离产生的氢离子均可抑制水的电离,故A项正确;B项中HCl和HX均为强酸,所以配成后的溶液中c(H+)=0.2 mol·L-1,故B项正确;C项中二者混合后发生反应生成等物质的量的NaX和CH3COOH,由于醋酸部分电离,所以溶液显酸性,故粒子浓度关系为c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-),C项错误;D项中可设HX和CH3COOH的物质的量均为a mol,欲使HX与NaOH溶液反应后溶液呈中性,则加入的NaOH的物质的量为a mol,欲使醋酸与NaOH溶液反应后溶液呈中性,则加入的NaOH的物质的量应小于a mol(因二者恰好完全反应时生成的醋酸钠溶液呈碱性),D正确。
本题难度:一般
5、选择题 下列事实可证明氨水是弱碱的是
[? ]
A.氨水能与H2SO4反应生成(NH4)2SO4
B.铵盐受热易分解
C.0.1mol/L的氨水可使酚酞试液变红
D.0.1mol/L NH4Cl溶液的pH约为5
参考答案:D
本题解析:
本题难度:一般