1、填空题 磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料。某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下:
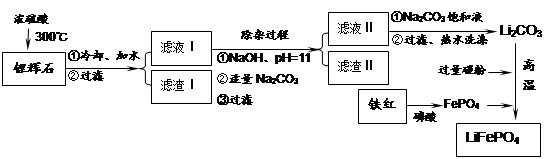
已知:2LiAl(SiO3)2 + H2SO4(浓) 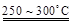 ?Li2SO4 + Al2O3·4SiO2·H2O↓
?Li2SO4 + Al2O3·4SiO2·H2O↓
温度/℃
| 20
| 40
| 60
| 80
|
溶解度(Li2CO3)/g
| 1.33
| 1.17
| 1.01
| 0.85
|
溶解度(Li2SO4)/g
| 34.2
| 32.8
| 31.9
| 30.7
|
?
(1)从滤渣Ⅰ中可分离出Al2O3,如下图所示。请写出生成沉淀的离子方程式?。
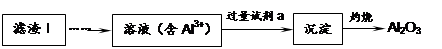
(2)滤渣Ⅱ的主要成分是:?(填化学式)。
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是?
?。
(4)写出在高温下生成磷酸亚铁锂的化学方程式?。
(5)磷酸亚铁锂电池总反应为:FePO4+Li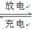 LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:?。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为?。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:?。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为?。
参考答案:(1)Al3++3NH3·H2O=Al(OH)3↓+3NH4+?(2分)
(2)Mg(OH)2、CaCO3(共4分,对一个得2分,答错不得分,但不倒扣分)
(3)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失(2分)
(4)2FePO4+ Li2CO3+2C  ?2LiFePO4+3CO↑(2分)
?2LiFePO4+3CO↑(2分)
(5)FePO4+Li++e-=LiFePO4(2分);1.4g(2分)
本题解析:(1)由已知化学方程式可知,滤渣Ⅰ的主要成分是Al2O3·4SiO2·H2O,要通过灼烧沉淀生成氧化铝,故沉淀为氢氧化铝,则必须加入过量的弱碱,如氨水;(2)锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐),故用氢氧化钠先中和过量的浓硫酸,再调高pH值,使镁离子变成氢氧化镁沉淀析出,钙离子则通过加入碳酸钠,生成碳酸钙沉淀析出,故滤渣Ⅱ的主要成分是Mg(OH)2、CaCO3;(3)由表中数据可知,Li2CO3的溶解度随温度升高而减小,故通过热水洗涤可减少碳酸锂的损失;(4)因加入过量碳粉,故碳粉必定不能完全反应,因此生成一氧化碳,而非二氧化碳,根据得失电子守恒进行配平;(5)电池放电时,正极发生还原反应,电极反应式为FePO4+Li++e-=LiFePO4;当电解饱和食盐水时,阳极为氯离子在放电,产生氯气,阴极为氢离子在放电,产生氢气,当两极共有4480mL气体产生,即0.1mol氯气和0.1mol氢气,转移0.2mol电子,相当于消耗0.2mol的锂,质量为1.4g。
点评:化工生产跟人类的生活息息相关,它是化学在现实生活中的最有用的应用,近年来化工生产在高考中的分量逐渐增大,考生在备考过程中应注意联系实际,学以致用。难度较大。
本题难度:困难
2、选择题 下列物品和设备所用材料为硅酸盐的是
[? ]
①陶瓷餐具;②门窗玻璃;③水晶镜片;④石英钟表;⑤光导纤维;⑥计算机芯片
A.②④⑤
B.①⑤
C.①②
D.③④⑥
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列物质的俗名与化学式不相符的一组是
| 选项 | 化学式 | 俗名
A
Na2SiO3
水玻璃
B
CaSO4?2H2O
石膏
C
NaNO3?10H2O
芒硝
D
CaCO3
石灰石
|