实?验?现?象
验证氧化性
验证不稳定性
参考答案:过氧化氢具有氧化性,能将还原性的硫离子氧化为单质硫,要探究其氧化性,可以让它和还原性的硫化氢或碘化钾反应,具体操作是:取适量饱和硫化氢溶液于试管中,滴入过氧化氢溶液(取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液),双氧水能将硫离子氧化为硫单质,能将碘离子氧化为单质碘,碘单质遇淀粉变蓝色;过氧化氢具有不稳定性,加热会生成水和氧气,氧气能使木条复燃,能和硫化氢反应生成淡化色沉淀硫单质,故答案为:实?验?内?容实?验?方?法实?验?现?象验证氧化性取适量饱和硫化氢溶液于试管中,滴入
过氧化氢溶液.(取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液.)产生淡黄色沉淀或溶液变浑浊.(溶液变蓝色.)验证不稳定性取适量过氧化氢溶液于试管中,加热,
用带火星的木条检验.(取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中.)产生气泡,木条复燃.(溶液变浑浊或有浅黄色沉淀产生)
本题解析:
本题难度:一般
2、填空题 (20分)聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:

已知:Fe3+、Al3+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2。
根据流程图回答下列问题:
(1)“煅烧”的目的是_______________________________________________。
(2)“浸出”过程中发生反应的离子方程式为_______________________________。
(3)“浸出”选用的酸为_______。配制质量分数15%的A酸需要200mL30%的A酸(密度约为1.15g/cm3)和_______g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
(4)为提高铝的浸出率,可采取的措施有?_______________(要求写出三条)。
(5)“调节溶液pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是___________?______。
(6)实验中制备碱式氯化铝反应的化学方程式为_________________
参考答案:(1)改变高岭土中氧化铝的结构,使其能溶于酸。
(2)Al2O3+6H+ ="=" 2Al3++3H2O? Fe2O3+6H+ ="=" 2Fe3++3H2O
(3)盐酸? 230?量筒
(4)加热或提高反应温度,将煅烧后的块状固体粉碎,适当增大盐酸浓度,充分搅拌,延长反应时间(任答3条)
(5)pH计(或精密pH试纸)?水浴加热?
(6)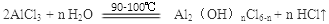
本题解析:“煅烧”的目的是改变高岭土中氧化铝的结构,使其能溶于酸。“浸出”过程中发生反应与酸反应。该酸要溶液挥发,不会形成杂质。为提高铝的浸出率,可采取的措施有加热或提高反应温度,将煅烧后的块状固体粉碎,适当增大盐酸浓度,充分搅拌,延长反应时间。控制温度的实验方法是水浴加热?。
本题难度:一般
3、选择题 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验方法不合理的是
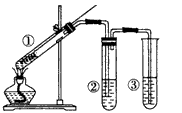
[? ]
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
参考答案:D
本题解析:
本题难度:一般
4、选择题 从绿色化学的理念出发,下列实验不宜用下图所示装置进行的是( )。
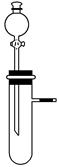
A.不同浓度的硝酸与铜反应
B.稀硫酸与纯碱或小苏打反应
C.铝与氢氧化钠溶液或盐酸反应
D.H2O2在不同催化剂作用下分解
参考答案:A
本题解析:绿色化学理念是不产生污染环境的物质,原子利用率高,消耗原料少,产量大,反应易进行,实验设计合理为宜,A不符合。
本题难度:一般
5、实验题 (14分)氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域。在氮气流中由氧化铝与焦炭在电炉中加热制得。原料配比不当或反应不完全等因素都会造成产品中含有碳、Al4C3或Al2O3等杂质。回答下列问题:
(1)反应Al2O3+N2+ 3C  2AlN+3CO中,氧化剂是??。 2AlN+3CO中,氧化剂是??。
(2)AlN也可以与强碱溶液反应。完成下列方程式:
AlN+NaOH+H2O=???+????
(3)Al 4C3与水反应生成甲烷,反应方程式是
甲烷与CuO反应的化学方程式如下:
CH4+4CuO  CO2+2H2O+4Cu CO2+2H2O+4Cu
为测定产品中有关成分的含量,所需仪器如下:
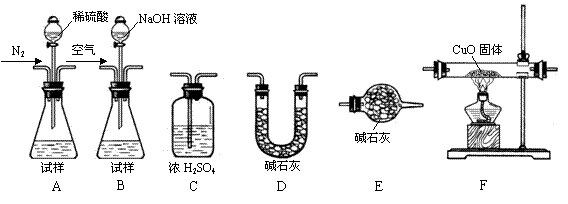 Ⅰ.测定样品中含有少量Al4C3的含量,各装置连接 Ⅰ.测定样品中含有少量Al4C3的含量,各装置连接 的顺序为A→C→F→C→D→E。主要实验步骤 的顺序为A→C→F→C→D→E。主要实验步骤 如下: 如下:
①称量D的质量,按顺序组装仪器,将试样放入锥形瓶中,检查装置的气密性
②从分液漏斗缓缓滴入稀硫酸,直到不再产生气体时为止
③点燃F酒精灯
④缓缓鼓入一定量的N2
⑤再次缓缓鼓入一定量的N2
⑥再次称量D的质量
⑦重复步骤⑤和⑥的操作,直到D的质量基本不变
操作的先后顺序是①→?→⑤→⑥→⑦,操作④的目的是? ??。 ??。
Ⅱ.为测定AlN的含量,请选择合适的药品和装置,按气流方向连接各装置,其顺序为:
?→??→??→E
若试样为mg,测得C增重n g,则AlN的质量分数是?。
参考答案:(14分)(1)N2?
(2)NaAlO2、NH3
(3)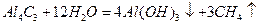
Ⅰ.④→③→②
将装置中的空气排尽,防止爆炸
Ⅱ.?B→D→C?
?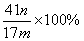
本题解析:略
本题难度:一般
|