1、选择题 某原电池总反应的离子方程式为Zn+2Fe3+=Zn2++2Fe2+,则下列说法正确的是
[? ]
A.该原电池的正极一定是Fe
B.电解质溶液中的阴离子向电池的正极移动
C.正极附近Fe3+浓度减少
D.一段时间后,负极变细,正极变粗
2、填空题 下列关于实验现象的描述,正确的是______
①由铜锌组成的原电池,电子是从锌经过导线流向铜
②把铜片和锌片紧靠在一起浸入稀硫酸中,铜表面出现气泡
③把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
④把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,产生气泡的速率加快.
3、填空题 在一个U形管里盛有CuCl2溶液,并插入两块锌片作电极,按如图连接。
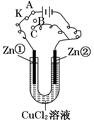
(1)如果把电键K接A,该装置应是电解装置,Zn①极是 极,电极反应式为 ,Zn②极是 极,电极反应式为 。
(2)上述反应进行5 min后,转换电键K到C,则这个装置是原电池装置,Zn①极是 极,电极反应式为 。
(3)上述装置进行2 min后,再转换电键K到B,则Zn①极发生的化学反应为 ,Zn②极发生的有关电化学的反应为 。
4、选择题 如图判断,下列说法正确的是

A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+
B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH-
C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大