1、填空题 在0.5mol/L的NaHSO3溶液中滴入石蕊,溶液变红。该溶液中HSO3-的电离程度______HSO3-的水解程度。
参考答案:大于
本题解析:HSO3-的电离使溶液呈酸性,HSO3-的水解使溶液呈碱性,根据指示剂变色,判断溶液呈酸性,故电离大于水解。
点评:酸式盐的酸碱性,由电离和水解的相对大小确定的。
本题难度:一般
2、选择题 在溶液中能大量共存的一组离子是?(?)
A.强酸溶液中:K+、Fe2+、NO2-、SO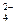
B.Na+、CO32-、SO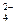 、Fe3+
、Fe3+
C.FeC12溶液中:K +、Na+、SO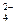 、A1O2-
、A1O2-
D.Na+、CH3COO—、CO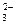 、NH4+
、NH4+
参考答案:D
本题解析:略
本题难度:简单
3、填空题 某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;将沉淀过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。
回答下列问题:
(1)原溶液中一定不存在 。
(2)根据实验和必要的计算确定溶液中一定存在的离子有哪些 (写出必要的推理及计算过程)。
参考答案:(1)CO32-(2分)(2)Fe3+、NH4+、SO42-和Cl-(2分)
本题解析:加入NaOH溶液共热有气体和红褐色沉淀,知溶液含NH4+、Fe3+,而不含CO32-,加BaCl2溶液生成不溶于盐酸的沉淀,知溶液中含SO42-。n(NH3)=0.02mol,知n(NH4+)=0.02mol,n(Fe2O3)=1.6g/160g·mol-1=0.01mol,知n(Fe3+)=0.02mol,n(BaSO4)=4.66g/233g·mol-1=0.02mol,知n(SO42-)=0.02mol,溶液中NH4+、Fe3+所带正电荷为0.02mol+3×0.02mol=0.08mol,SO42-所带负电荷为2×0.02mol=0.04mol,据电荷守恒,知溶液中必然大量存在另一种阴离子,由题意知为Cl-,综上知,原溶液中一定含Fe3+、NH4+、SO42-和Cl-。
考点:考查溶液中离子的共存和离子的判断,同时考查了电荷守恒原理的运用。
本题难度:困难
4、填空题 将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组:_________________________________。
B组:_________________________________。
参考答案:A组:Na+、K+、CO32-、OH-
B组:Cu2+、H+、NO3-、Cl-(可互换)
本题解析:
本题难度:一般
5、选择题 下列各组中的离子,能在溶液中大量共存的是( )
A.H+ Na+CO32-Cl-
B.Ba2+Na+NO3-H+
C.K+ H+ SO42-OH-
D.Ag+ Al3+ Cl-SO42-
参考答案:B
本题解析:A不能,氢离子和碳酸根离子不能共存.
B可以.
C不能,氢离子和氢氧根离子不能大量共存.
D不能,银离子和氯离子不能大量共存.
本题难度:一般