1、填空题 (14分)用如下图所示装置可以完成一系列实验(图中夹持装置已略去)
请回答下列问题:
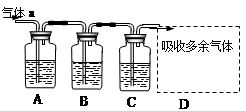
Ⅰ.若气体a是Cl2,装置A、B、C中的试剂依次为: FeCl2溶液、淀粉KI溶液、石蕊溶液。
装置
| A
| B
| C
| D
|
试剂
| FeCl2溶液
| 淀粉KI溶液
| 石蕊溶液
| ?
?
|
现象
| 溶液由浅绿色变为棕黄色
| ?
?
| ?
?
| ?
|
离子方程式
| ?
?
| ?
?
| ?
| ?
?
|
II.若气体a是SO2,装置A、B、C中的试剂依次为:品红溶液、酸性高锰酸钾溶液、氢硫酸(硫化氢的水溶液)。
装置
| A
| B
| C
|
试剂
| 品红溶液
| 酸性高锰酸钾溶液
| 硫化氢的水溶液
|
现象
| ?
| 紫色退去
| ?
|
体现SO2的性质
| ?
| ?
| 氧化性
|
(1)写出C中发生反应的化学方程式?。
(2)D装置中用氢氧化钠溶液来吸收SO2,为了防止倒吸,应该选用下列装置中的?(填序号)。
参考答案:(14分)
装置
A
B
C
D
试剂
?
?
?
NaOH溶液
现象
?
溶液变蓝
先变红后退色
?
离子方程式
Cl2+ 2Fe2+ = 2Fe3+ +2Cl-
Cl2+2I-=I2 +2Cl-??
?
Cl2+2OH-= Cl- +ClO-+2H2O
?
装置
A
B
C
试剂
?
?
?
现象
?红色退去?
?
生产淡黄色沉淀?
体现SO2的性质
?漂白性?
?还原性?
?
(以上表中每空1分)
(1)SO2 + 2H2S ="=3S↓+" 2H2O(2分)
(2)①③(2分)
本题解析:若气体a是Cl2,装置A、B、C中的试剂依次为: FeCl2溶液、淀粉KI溶液、石蕊溶液;氯气和氯化亚铁反应生成氯化铁;和碘化钾反应生成碘单质;会使石蕊先变红后褪色;尾气要用氢氧化钠来吸收。若气体a是SO2,装置A、B、C中的试剂依次为:品红溶液、酸性高锰酸钾溶液、氢硫酸(硫化氢的水溶液),品红会褪色,酸性高锰酸钾也会褪色;氢硫酸会生成黄色沉淀。
点评:氯气和二氧化硫的性质中需要特别注意的是:氯气溶于水后生成的次氯酸具有强氧化性,会使有色物质褪色后不再恢复;二氧化硫是化合性的漂白剂,使物质褪色后还能恢复。
本题难度:一般
2、实验题 (7分)某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置。
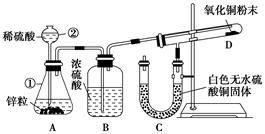
(1)写出编号仪器的名称:
①________,②________。
(2)浓硫酸的作用是_________________________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1个水分子,转移的电子数为________。
参考答案:(1)锥形瓶?长颈漏斗?(2)除去H2中的水蒸气?(3)D
(4)白色无水CuSO4固体变蓝?黑色CuO逐渐变红?(5)2
本题解析:(1)根据仪器的结构可知,①是锥形瓶,②是长颈漏斗。
(2)由于参加反应的氢气应该是干燥的,所以浓硫酸的作用是除去H2中的水蒸气。
(3)氢气还原氧化铜需要加热,所以答案选D。
(4)氢气还原氧化铜的方程式为H2+CuO=Cu+H2O,所以D中的现象是黑色CuO逐渐变红;C中的现象是白色无水CuSO4固体变蓝。
(5)根据方程式可知,氧化铜中Cu元素的化合价从+2价降低到0价,所以生成1个水分子时,转移2个电子。
本题难度:一般
3、选择题 用0.20mol/L的NaOH溶液滴定100.0mL0.20mol/LHCl溶液时,滴定误差在±0.1%以内,反应完毕后溶液的pH变化范围是
A.5~9
B.4.0~10.0
C.4.3~9.7
D.以上都不正确
参考答案:B
本题解析:(1)计量点前计量点前误差为+0.1%时,即滴入NaOH的体积为99.9mL,NaOH不足。
此时锥形瓶溶液中是中和生成的NaCl和剩余的HCl。所以只要计算该溶液的PH值即可。
剩余的n(HCl)=n(HCl总)-n(NaOH)=0.2*(100.00-99.9)*10^-3=2*10^-6(mol)
则PH(前)=lg[c(HCl)]=4。
(2)计量点后半滴,即加入NaOH的体积为100.1mL,NaOH过量,此时为NaCl和NaOH的混合溶液,所以计算时只需考虑NaOH即可。
n(NaOH过量)=n(NaOH总)-n(NaOH反应)=0.2*(100.1-100)*10^-3)=2*10^-5(mol)
此时溶液体积v=100.00+100.1=200.1mL=200.1*10^-3(L),
所以[OH-]=n(NaOH过量)/v="2*10^-5/(200.1*10^-3)=1/100.05" *10^-2(mol/L)
[H+]=10^-14/[OH-]? PH(后)=-lg[H+]=10所以突跃范围为4~10。故选B。
点评:酸碱中和滴定突跃范围的计算实际上也是强酸、强碱互相混合的计算,其规律是
(3)酸I+碱II
完全中和:[H+] =" [OH-]" = 1 mol/L
mol/L
酸过量:? [H+]= 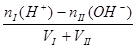
碱过量:[OH-] = 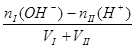
滴定突跃范围指计量点前半滴和后半滴滴定剂所引起的锥形瓶中溶液PH值的变化范围。要控制误差为+/-0.1%时。由于计量点时酸碱恰好完全反应,也就是滴入NaOH的体积为100.00mL时达计量点,所以计量点前误差为+0.1%时,是指加入NaOH的体积为99.9mL,而计量点后误差为-0.1%时指加入NaOH的体积为100.1mL。因此计算滴定突跃范围,只要计算出计量点前、后半滴时锥形瓶中溶液的PH(前)和PH(后)即可。
本题难度:简单
4、实验题 (14分)某学校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究。
甲同学:为制备消毒液,探究并制作了一种家用环保型消毒液(NaClO溶液)发生器,设计了如图所示的装置,用石墨作电极电解饱和氯化钠溶液。
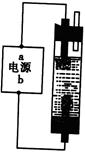
请完成下列问题:若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源的a电极名称为?极(填“正”、“负”、“阴”或“阳”);装置溶液中反应生成NaClO的离子方程式为:?。
乙同学:从某超市中查询到某品牌消毒液包装说明的部分内容,摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。
请完成以下实验探究过程:
I.阅读材料,根据学过的知识判断问题?
(1)室温条件下,该消毒液(NaClO)的不显中性的原因是(用离子方程式表示)
_____________________。
(2)该消毒液还具有的化学性质是_________(填序号)。
A.强氧化性? B.强还原性? C.不稳定性? D.漂白性? E.弱酸性
(3)从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示)
_?。
II.确定要研究的问题
该消毒液对碳钢制品的腐蚀原理。
III.设计方案,实施探究
(1)用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,浸泡一段时间。
预期的实验现象是_________________________________。
(2)为了进一步探究铁钉在该漂白剂(NaClO)溶液中的腐蚀原理,丁同学设计了如下图实验装置,写出碳(C)极上发生的电极反应式:?。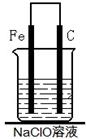
参考答案:甲:负(1分)Cl2+2OH-===Cl-+ClO-+H2O(2分)
乙:I.(1)ClO-+H2O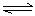 HClO+OH- (2分)
HClO+OH- (2分)
(2)A、D(2分)2NaClO+CO2+H2O=Na2CO3+2HClO(2分)? 2HClO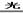 2HCl+O2↑(2分)
2HCl+O2↑(2分)
III.(1)钢钉表面有红褐色物质生成(2分)
(2)ClO-+2e-+H2O=Cl-+2OH-(2分)
本题解析:电解NaCl溶液生成氢氧化钠、氢气和氯气,氯气与氢氧化钠反应生成次氯酸钠,次氯酸钠因为水解显碱性。次氯酸钠具有强氧化性和漂白性。如果接触到空气中CO2,就会生成HClO,HClO分解就会使消毒液失效。将碳钢铁钉浸在次氯酸钠中,会发生电化学腐蚀。其中铁为负极,碳为正极。铁失电子,因为次氯酸根离子的强氧化性,次氯酸根离子得电子生成Cl—。
本题难度:简单
5、实验题 (9分)欲用无水CuSO4粉末配 制500mL 0.1mol·L—1?CuSO4溶液。根据题意填空:
制500mL 0.1mol·L—1?CuSO4溶液。根据题意填空:
(1)如图所示仪器,配制上述溶液肯定不需用到的是?(填字母)配制上述溶液还需要的玻璃仪器有? ?(填仪器名称)。
?(填仪器名称)。
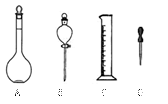
(2)配制该溶液应选用??mL容量瓶,使用容量瓶之前必须进行?。?
(3)配制该溶液 应用托盘天
应用托盘天 平称
平称 取??g无水CuSO4。
取??g无水CuSO4。
(4)使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度?
偏低的是?(填编号)。
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②向容量瓶中转移溶液时不慎将液滴洒在容量瓶外面
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
参考答案:(9分)
(1)B,?烧杯、玻璃棒(2分)
(2)500?, 检漏
(3)8.0g
(4)①②③⑤⑥(3分)(错选、漏选酌情给分)
本题解析:略
本题难度:简单