1、填空题 (9分)在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题,

已知A、B、C中均含有同一种元素,D为非金属单质,能使带有火星的木条复燃。
(1)若A在常温下为气体,C是红棕色气体。
①写出A单质的电子式?。
②C与水反应所得的溶液呈酸性,此反应中氧化剂与还原剂物质的量之比为 ?
(2)若A为固体单质,C为淡黄色固体,,则C含有的化学键有?,
A与水反应的离子方程式为?。
(3)若A为日常生活中最常见的烃的衍生物,则A与C反应生成一种有水果香味的物质,其反应的化学方程式为??,?反应类型为?反应。
参考答案:(9分)
⑴①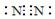 。② 1:2
。② 1:2
⑵离子键和共价键,? 2Na+2H2O=2Na++2OH- +H2↑
⑶ CH3CH2OH+CH3COOH→CH3COOCH2CH3+H2O?酯化
本题解析:略
本题难度:简单
2、填空题 (14分)短周期元素形成的纯净物A、B、C、D、E的转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。

请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的一 种化学式?。
种化学式?。
(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因?。
②E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间大小关系?。
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为?。
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,浓硫酸变为红棕色,则你得出的结论是?。

③已知常温下物质A与物质B生成1mol气体C的△H为-57.07kJ·mol-1,1 mol气体C与H2O反应生成D溶液和E气体的△H为-46kJ ·mol-1,写出物质A与物质B及水生成D溶液的热化学方程式?。
参考答案:(共14分)(1)Na2O2(或NaH)(2分)
(2)①H++A1O2-+H2O? A1(OH)3?A13++3OH-?(2分)
②c(Na+)> c(S2-)> c(OH-)> c(HS-)>c (H+)(3分)
(3)①3NO2+H2O=2HNO3+NO(2分)
②NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO?2?(2分)
③4NO(g) +3O2(g)+2H2O(1)=4HNO3(aq);△H=-618.42kJ·mol-1(3分)
本题解析:略
本题难度:一般
3、填空题 (12分)下图中,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色。
回答下列问题:
(1)K所含的化学键有?。
(2)D的水溶液与G反应的总离子方程式为_______________________________________________。
(3)写出工业上制取单质G的化学方程式?。
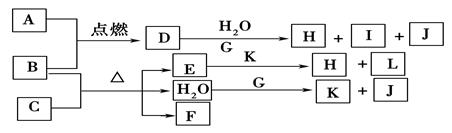
(4)将气体F通入下列装置中
写出A、B中的离子方程式:
?、?。
(5)若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的关系式为?
?。
参考答案:(1)离子键、共价键(2)6Na+2Fe3++6H2O===2Fe(OH)3↓+6Na++3H2↑(3)2NaCl 2Na+Cl2↑(4)SO2+2Fe3++2H2O=SO42-+Fe2++4H+? SO2+I2+2H2O=4H++2I-+SO42-(5)c(Na+)+c(H+)=c(OH-)+c(HSO)+2c(SO)
2Na+Cl2↑(4)SO2+2Fe3++2H2O=SO42-+Fe2++4H+? SO2+I2+2H2O=4H++2I-+SO42-(5)c(Na+)+c(H+)=c(OH-)+c(HSO)+2c(SO)
本题解析:该题的突破口为B在A中燃烧为棕色的烟,可能为Fe在氯气中燃烧现象;I焰色为黄色,为钠的化合物;J中只有质子为H;F是品红褪色为SO2;结合框图综合考虑可以确定:A为Cl2,B为Fe,C为H2SO4,D为FeCl3,E为Fe2(SO4)3、F为SO2,G为Na,H为Fe(OH)3,I为NaCl,J为H2,K为NaOH,L为Na2SO4;
(1)氢氧化钠含离子键和极性共价键。
(2)钠与氯化铁溶液反应可认为钠先与水反应,生成的氢氧化钠再与氯化铁溶液反应,离子方程式为6Na+2Fe3++6H2O===2Fe(OH)3↓+6Na++3H2↑。
(3)工业上电解熔融氯化钠制钠,方程式为2NaCl 2Na+Cl2↑。
2Na+Cl2↑。
(4)二氧化硫通入氯化铁、碘水中发生氧化还原反应,离子方程式分别为SO2+2Fe3++2H2O=SO42-+Fe2++4H+? SO2+I2+2H2O=4H++2I-+SO42-。
(5)二氧化硫通入氢氧化钠溶液中所得溶质成分可能有四种:亚硫酸钠和氢氧化钠、亚硫酸钠、亚硫酸钠和亚硫酸氢钠、亚硫酸氢钠,无论哪种情况均有电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HSO)+2c(SO)。
点评:充分挖掘题眼,利用特征现象、特征反应确定物质。
本题难度:一般
4、选择题 已知:甲 乙
乙 丙
丙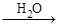 丁,其中丁为强酸,则甲不可能为
丁,其中丁为强酸,则甲不可能为
A.N2
B.C
C.S
D.NH3
参考答案:B
本题解析:A中含有氮元素的各物质分别为N2,NO,NO2,HNO3。B中各物质依次为? C,CO,CO2,H2CO3。C中各物质依次为? S,SO2,SO3,H2SO4。D中各物质依次为NH3,? NO,NO2,HNO3。答案选B。
本题难度:一般
5、填空题 (13分)已知:正盐A强热可得到B、C、D、E四种物质,B通常情况下为无色无味液体,E、F 是空气主要成分,D能产生酸雨,I为红棕色气体,C与J反应可得A,J、K为两种常见的酸。物质之间的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。 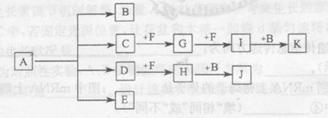
请回答下列问题:
(1)E物质的电子式是________。
(2)检验C的试纸是________,检验D的试剂是________(填试纸、试剂名称)。
(3)写出A强热分解生成B、C、D、E的化学方程式________。
(4)写出D通人FeCl3溶液时,发生反应的离子方程式_____ 。
(5) —定浓度J、K混合后的稀溶液200mL,平均分成两份。向其中一份中逐渐加人铜粉,最多能溶解a g(产生气体只为G)。向另一份中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示。则①a=________g,②气体G标准状况下体积为________,③J的物质的量浓度为______。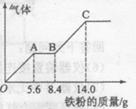
参考答案:(13分)(1) (2分) (2)红色石蕊试纸?品红溶液 (2分)
(2分) (2)红色石蕊试纸?品红溶液 (2分)
(3)3(NH4)2SO4 6H2O+4NH3↑+3SO2↑+N2↑ (3分)
6H2O+4NH3↑+3SO2↑+N2↑ (3分)
(4)SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ (3分)
(5)①9.6g (1分) ②2.24L (1分) ③2.5mol/L (1分)
本题解析:B通常情况下为无色无味液体,因此B应该是水。E、F 是空气主要成分,则二者是氮气和氧气。D能产生酸雨,所以D是SO2。SO2能和F反应生成H,则F是氧气,E是氮气,H是三氧化硫。三氧化硫和水反应生成J,J是硫酸。I为红棕色气体,则I是NO2。G和氧气反应生成NO2,所以G是NO。NO2溶于水生成硝酸和NO。K是酸,则K是硝酸。C和氧气反应生成NO,且C与J反应可得A,所以C是氨气,A就是硫酸铵。
(1)氮气是含有非极性键的单质,其电子式是 。
。
(2)氨气是碱性气体,可用红色石蕊试纸检验;SO2具有漂白性,可用品红溶液检验。
(3)A强热分解生成B、C、D、E的化学方程式3(NH4)2SO4 6H2O+4NH3↑+3SO2↑+N2↑。
6H2O+4NH3↑+3SO2↑+N2↑。
(4)SO2具有还原性,能被铁离子氧化,因此该反应的离子方程式是SO2+2Fe3++2H2O=SO42-+2Fe2++4H+。
(5)硝酸是氧化性酸,所以根据图像可知,O→A发生的反应是Fe+4H++NO3-=Fe3++NO↑+2H2O。A→B发生反应的方程式是2Fe3++Fe=3Fe2+;B→C发生反应的方程式是Fe+2H+=Fe2++H2↑。三阶段中消耗铁的物质的量分别是5.6g÷56g/mol=0.1mol、(8.4g-5.6g)÷56g/mol=0.05mol、(14.0g-8.4g)÷56g/mol=0.1mol,所以根据氮元素守恒可知,硝酸的物质的量是0.1mol。最终溶液中只有硫酸亚铁,则根据原子守恒可知,硫酸亚铁的物质的量是0.25mol,因此硫酸的物质的量也是0.25mol,则硫酸的浓度是0.25mol÷0.1L=2.5mol/L。另一份溶液中,氢离子和NO3-的物质的量分别是0.6mol和0.1mol,则根据方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,氢离子过量,所以NO3-完全被还原生成NO,则NO的物质的量是0.1mol,在标准状况下的体积是2.24L。其中溶解铜的质量是0.15mol×64g/mol=9.6g。
本题难度:困难