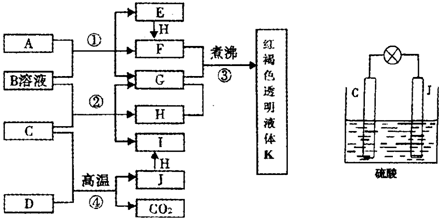
1、简答题 已知D、H是常见的非金属单质,其中H是黄绿色气体.J是一种金属单质,J元素的+2价化合物比+4价化合物稳定.D、J元素在周期表中同主族,D是形成化合物种类最多的元素.A、C是金属氧化物,C和J均是某种常见电池的电极材料,B与C反应时,每生成1mol?H同时消耗4mol?B和1mol?C.它们之间的关系如图:
(1)写出物质A的化学式______.
(2)写出反应②的化学方程式______.
(3)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用______方法(填序号).
①热分解法?②热还原法?③电解法
其中从A得到其相应金属也可以用铝热法,若反应中lmolA参加反应,转移电子的物质的量为______mol.
(4)用C、J作电极,与硫酸构成如图所示电池,工作时电池发生的总反应式为__ 91eXAm.org____,当反应转移1mol电子时,溶液中消耗H+的物质的量为______mol.
(5)向框图中的红褐色透明液体K中逐滴滴入HCl溶液.可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,请解释原因______
2、推断题 下列框图中所有反应的反应物和生成物均已列出,部分反应的反应条件未列出。其中反应①、②是工业生产中的重要反应,反应④是复分解反应,B、C、H是单质,A和D中“原子”组成个数比互为倒数,E是一种最常见的溶剂,J是一种温室气体,F的焰色反应呈黄色。I分解得到的G与J恰好能完全反应生成E和氮肥K。

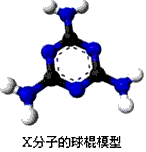
请回答下列问题
(1)A的化学式是____________;I的化学式是____________。
(2)G的电子式是____________。
(3)反应③的化学方程式是________________________。
(4)气体J和少量F溶液反应的离子方程式为________________________。
3、简答题 下列物质A~G是我们熟悉的单质或化合物,其中A、B均是常见的金属,E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化.
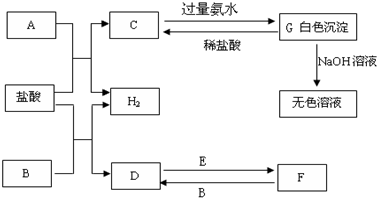
试回答下列问题:
(1)写出E的电子式______
(2)写出C→G的离子方程式______
写出沉淀G与氢氧化钠溶液反应的化学方程式______
(3)写出D→F的离子方程式并用双线桥标出电子转移方向与数目______
(4)检验F中金属阳离子的试剂(写化学式)______.
4、填空题 (13分)室温下,单质A为日常生活中使用最广泛的金属;单质B为黄绿色气体,单质C为常温常压下密度最小的无色气体。在合适的条件下,它们可以按如图所示进行反应,又知D溶液为黄色,E溶液为无色。
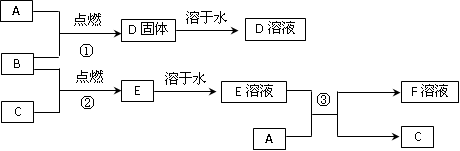
(1)写出下列物质的化学式:
D________________?; E? _________________?;? F? ____________________?。
(2) 写出F溶液在空气中与氢氧化钠溶液反应的化学方程式:____________________。
5、选择题 (单选题)某工厂用CaSO4、H2O、NH3、CO2制备(NH4)2SO4,其工艺流程如下:
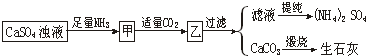
下列推断不合理的是( )
A.往甲中通CO2有利于(NH4)2SO4生成
B.生成1mol(NH4)2SO4至少消耗2molNH3
C.CO2可被循环使用
D.直接蒸干滤液能得到纯净(NH4)2SO4