1、简答题 图中B、F为单质,其他为化合物,它们之间存在如下转化关系(部分反应物、生成物及反应条件已略去).其中,A、C是工业上用途很广的两种重要化工原料,C的焰色反应为黄色,B为日常生活中常见的金属,H、G分子均具有正四面体结构,H是一种重要的能源.J是一种较好的耐火材料,K是极易溶于水的碱性气体,请回答下列问题:
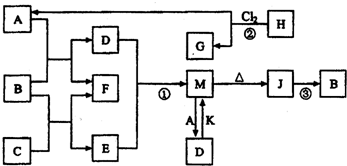
(1)C中存在的化学键类型为______;G的电子式为______.
(2)反应②进行的条件______.
(3)反应①的离子方程式为______.
反应③的化学方程式为为______.
(4)向D溶液中通入K可生成M和另一种物质X,写出鉴定X中阳离子的实验方法和现象为______.
(5)碘和氯的原子序数之差为36,放射性131的原子核内中子数为______,碘在元素周期表中的位置为______.
(6)我国首创的海洋电池以B单质为负极,铂网为正极,海水为电解质溶液,空气中的氧气与B反应产生电流.该电池的正极反应式为______.
参考答案:H、G分子均具有正四面体结构,H是一种重要的能源,则H是甲烷,G是CCl4,A为HCl;B为日常生活中常见的金属,盐酸和B反应生成盐和氢气,F是单质,所以F是氢气,A、C是工业上用途很广的两种重要化工原料,C的焰色反应为黄色,所以C中含有钠元素,金属B能和盐酸反应也能和钠的化合物反应生成氢气,则B是铝,C是氢氧化钠,D是氯化铝,E是偏铝酸钠,氯化铝和偏铝酸钠反应生成氢氧化铝和氯化钠,M能加热生成J,所以M是氢氧化铝,J是一种较好的耐火材料,J是氧化铝,K是极易溶于水的碱性气体,则K是氨气.
(1)C是氢氧化钠,钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键,G是CCl4,其电子式为:

,故答案为:离子键、共价键;

;
(2)甲烷和过量氯气在光照条件下发生取代反应生成四氯化碳,故答案为:光照、过量Cl2;
(3)氯化铝和偏铝酸钠反应生成氢氧化铝和氯化钠,离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,电解熔融态的氧化铝来冶炼铝,同时生成氧气,反应方程式为:2Al2O3(熔融)?电解?.冰晶石4Al+3O2↑,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;2Al2O3(熔融)?电解?.冰晶石4Al+3O2↑;
(4)氯化铝和氨水反应生成氢氧化铝和氯化铵,要检验铵根离子,向含有铵根离子的溶液中加入可溶性碱,同时加热,用蓝色石蕊试纸检验氨气的存在,氨气能使蓝色石蕊试纸变红,
故答案为:取少量X溶液于试管中,用胶头滴管滴入NaOH溶液,将湿润的红色石蕊试纸置于试管口,加热试管,可观察到红色石蕊试纸变蓝;
(5)碘和氯的原子序数之差为36,则碘的原子序数=17+36=63,放射性131的原子核内中子数=131-53=78,碘位于第五周期第ⅦA族,故答案为:78;第5周期第ⅦA族;
(6)正极上氧气得电子发生还原反应,同时生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-(或3O2+6H2O+12e-=12OH-),故答案为:O2+2H2O+4e-=4OH-(或3O2+6H2O+12e-=12OH-).
本题解析:
本题难度:一般
2、填空题 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
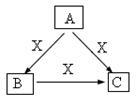
(1)若A、B、C中均含同一种常见金属元素,该元素在 C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素的原子结构示意图为?。
②该金属元素的单质与某红色氧化物在高温下反应,可用于焊接铁轨及定向爆破,已知:1mol该单质完全反应,当温度恢复至298K时,共放热QkJ,请写出该反应的热化学反应方程式为?。
(2)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①用化学方程式表明B溶液呈碱性的原因?。
②自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。
参考答案:(1)① ②2Al(s)+Fe2O3(s)
②2Al(s)+Fe2O3(s) ?Al2O3(s)+2Fe(s); △H=-2QkJ/mol
?Al2O3(s)+2Fe(s); △H=-2QkJ/mol
(2)①CO32-+H2O OH-+ HCO3-
OH-+ HCO3-
② 2.65 g
本题解析:(1)①若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠,因此可得出A中含金属元素Al的结构示意图。
②该金属元素的单质与某红色氧化物在高温下反应为铝与Fe2O3发生的铝热反应,配平后Al的系数为2,则△H=-2QkJ/mol,则人化学方程式为2Al(s)+Fe2O3(s) ?Al2O3(s)+2Fe(s); △H=-2QkJ/mol
?Al2O3(s)+2Fe(s); △H=-2QkJ/mol
(2)①若A、B、C的焰色反应均呈黄色,水溶液均为碱性,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳。Na2CO3溶液呈碱性的原因是CO32?发生了水解反应,方程式为:CO32-+H2O OH-+ HCO3-。
OH-+ HCO3-。
②溶液中金属阳离子的浓度为0.5 mol?L?1,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为1/2×0.1L×0.5mol/L×106g/mol=2.65g。
本题难度:一般
3、选择题 三种不同物质有如图所示转化关系:甲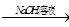 乙
乙 丙
丙 甲,则甲不可能是
甲,则甲不可能是
A.Al2O3
B.SiO2
C.CO2
D.NH4Cl
参考答案:D
本题解析:氯化铵和氢氧化钠反应生成氨气,氨气溶于盐酸生成氯化铵,氯化铵分解生成氨气和氯化氢,因此选项D不符合。其余都是符合的,答案选D。
本题难度:简单
4、填空题 (9分)有A、B、C、D、E、F、G、H、I等九种常见物质,它们的转化关系(反应条件未注明)如下图所示。已知:B、C、F为单质,常温常压下,B为固态,C、F为气态;化合物中仅A、E为气态;常温下,D为淡黄色粉末,H的焰色反应为黄色。G为无色液体。
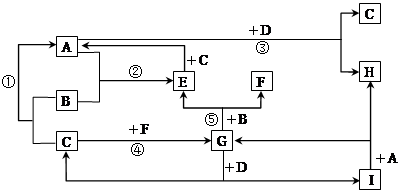
(1)写出G与D反应的离子方程式___________________________。
(2)写出B与G反应的化学方程式_____________________________。
(3)在①、②、③、④、⑤五个反应中,△H>0的反应是___(填代号)。
(4)E是一种可燃性气体,已知4.0gE在氧气中完全燃烧放出71kJ热量,写出该反应的燃烧热的热化学方程式: __________________________?
(5)请写出化合物A的电子式____________________
参考答案:(1) 2Na2O2+2H2O=4Na++4OH-+O2↑? (2分)
(2)C+H2O CO+H2?(2分)(3)②、⑤? (2分)
CO+H2?(2分)(3)②、⑤? (2分)
(4) CO(g)+1/2O2(g)=CO2(g) ;△H=-497kJ/mol? (2分)?(5)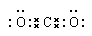
本题解析:本题是无机框图题,关键是找准突破点。D为淡黄色粉末,H的焰色反应为黄色,G为无色液体,所以D是过氧化钠,G是水。F是气态氢氧化钠单质,E是气态化合物,所以B是碳,F是氢气,E是CO。则A是CO2,C是氧气,H是碳酸钡,I是氢氧化钠。
(3)考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。所以②⑤是吸热反应。
(4)燃烧热是指在一定条件下,1mol可燃物尾气燃烧生成稳定的氧化物时发出的热量,所以CO的燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2(g) ;△H=-497kJ/mol。
(5)CO2是由极性键形成的共价化合物,电子式为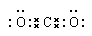 。
。
本题难度:一般
5、推断题 A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。 B、E均为组成空气的成分。F的焰色反应呈黄色。在G 中,非金属元素与金属元素的原子个数比为 1:2。在一定条件下, 各物质之间的相互转化关系如下(图中部分产物未列出):请填写下列空白
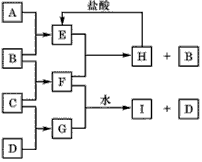
(1)A是__________ ,C是____________ 。
(2)H与盐酸反应生成E的化学方程式是__________。
(3)E与F反应的化这方程式是___________ 。
(4)F与G的水溶液反应生成I和D的离子方程式是_______________ 。
参考答案:(1)A:碳(或C); C:钠(或Na)
(2)Na2CO3 + 2HCl ==2NaCl + H2O + CO2↑
(3)2CO2 + 2Na2O2 ==2Na2CO3 + O2
(4)Na2O2 + S2- + 2H2O== 4OH- + S↓+ 2Na+
本题解析:
本题难度:一般