|
高中化学知识点大全《无机综合与推断》试题预测(2020年最新版)(四)
2020-08-23 08:10:07
【 大 中 小】
|
1、填空题 (11分)阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是?(填序号)
A.氢
B.碳
C.氧
D.硫
| 信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有一种是铝元素?为什么?
?;?。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为?。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为? ?。 ?。
信息⑤:上述四种元素中,X与W同主族。
(5)X与浓硫酸反应的化学方程式为?。
参考答案:(1)AD(2分)
(2)是(1分),因为有一种氧化物既能溶于酸,又能溶于碱,是两性氧化物(2分)。
(3)Mg(OH)2(2分)
(4)SiO32-+2H+=H2SiO3↓(2分)
(5)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(2分) CO2↑+2SO2↑+2H2O(2分)
本题解析:略
本题难度:一般
2、填空题 (12分)Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,化合物D的焰色反应为黄色,C和G混合冒白烟并生成A,电解E的水溶液常用于某种工业生产。
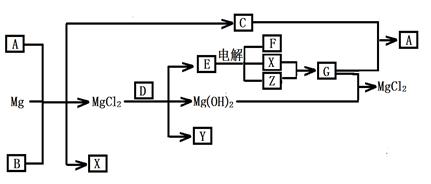
(1)写出下列物质的化学式
A???Y??
(2)写出C的电子式?
(3)写出MgCl2与D反应的化学方程式?
(4)请用水解平衡理论解释A+B+Mg→C+X+ MgCl2的原因_______________________。
(5)将0.1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的 关系如下图所示:则原F溶液的浓度为?mol/L。 关系如下图所示:则原F溶液的浓度为?mol/L。
参考答案:

本题解析:略
本题难度:一般
3、简答题 某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色沉淀,I为红褐色沉淀.(此转化关系中所用的试剂都是足量的)
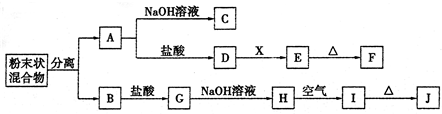
(1)写出下列物质的化学式:F______,G______.
(2)将混合物中两种金属分离开的最简单的方法是______.
(3)D→E的转化中,加入过量的X可能是______.
A.饱和NaCl溶液?B.NaOH溶液?C.氨水?D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______;
H→I:______.
参考答案:(1)依据判断FG的化学式为:F为Al2O3,G为FeCl2,故答案为:Al2O3;FeCl2;
(2)混合物中两种金属分离开的最简单的方法是利用铁可以被磁铁吸引,方法为:用磁铁靠近粉末状混合物,将铁粉吸附在磁铁表面,
故答案为:用磁铁靠近粉末状混合物,将铁粉吸附在磁铁表面;
(3)D→E的转化中是X和氯化铝反应生成氢氧化铝的反应,依据实验室制取氢氧化铝的方法和氢氧化铝的性质分析,氢氧化铝能溶于过量强碱溶液中,所以加入过量的X可能是氨水,
故答案为:C;
(4)A→C是Al和氢氧化钠反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;H→I是氢氧化亚铁被氧化为氢氧化铁,该反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
本题解析:
本题难度:一般
4、推断题 A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:

(1)A、D的化学式:
A.____________, D.____________。
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)
B→C:________________________________________________________________________;
E→B:________________________________________________________________________;
F→C:________________________________________________________________________。
参考答案:(每空2分,共10分)? (1)A.Na D.NaCl (2)2OH-+CO2===CO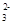 +H2O +H2O
2Na2O2+2H2O===4Na++4OH-+O2↑?CO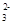 +H2O+CO2===2HCO +H2O+CO2===2HCO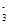
本题解析:E是淡黄色粉末,且A在氧气中点燃生成E,则E应该是过氧化钠。根据反应的条件以及转化特点可判断,A是钠,B是氢氧化钠,C是碳酸钠,D是氯化钠,F是碳酸氢钠。
点评:该题是高考中的常见题型,属于中等难度的试题。该题基础性强,难度不大。主要是考查学生对钠及其化合物性质和转化的熟悉掌握程度,有利于培养学生的逻辑推理能力和规范答题能力,也有助于提高学生的应试能力和学习效率。
本题难度:一般
5、简答题 中学化学中几种常见物质的转化关系如图所示,A是常见金属单质,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体.

请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围______;
(2)写出D的一种工业用途:______;
(3)①写出H2O2的电子式:______;
②写出B→G的化学方程式______;
③写出F转化为E的离子方程式______.
参考答案:已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体推断H为Fe(OH)3,C+Cl2→F,判断F为FeCl3,C为Fe,E和过氧化氢反应生成F,说明E为FeCl2,转化关系中的B、D都和氢氧化钠反应,A+B=C+D是金属置换铁的置换反应,判断为A为Al,B为Fe2O3,D为Al2O3,G为NaAlO2,
(1)胶体粒子直径介于1~100nm,故答案为:1~100nm;
(2)D为Al2O3,熔点高,可用与耐高温材料,还可用于冶炼铝,故答案为:耐火材料或电解法制金属铝;
(3)①H2O2的电子式为: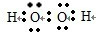 ,故答案为: ,故答案为: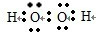 ; ;
②铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
③氯化铁具有强氧化性,可与铁反应生成氯化亚铁,反应的方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.
本题解析:
本题难度:一般
|  ?。
?。