1、选择题 下图表示的是难溶氢氧化物在不同pH下的溶解度 (S,mol/L),下列说法中正确的是
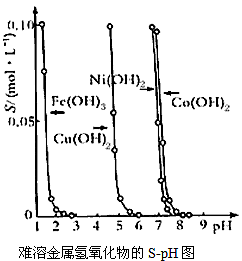
[? ]
A.pH=3时溶液中铁元素的主要存在形式是Fe3+
B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去
C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右
D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Cu(OH)2优先沉淀
参考答案:CD
本题解析:
本题难度:一般
2、填空题 (16分)
(1)等物质的量的A和B,混合于2L的密闭容器中,发生反应3A(g)+B(g)=xC(g)+2D(g),经过5min时,测得D的浓度为1mol/L,c(A):c(B)=3:4,C的反应速率是0.2mol?L-1?min-1,A在5min末的浓度是______,x的值是______.
(2)1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图(各物质为气体)
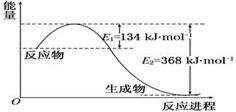
写出NO2和CO反应的热化学方程式____________________
(3)已知可逆反应:M(g)+N(g)  P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为____
②平衡后,升高温度,平衡常数 。(增大、减小)
(4)t ℃时,水的离子积常数为1×10-13,则该温度 25℃(填大于,小于)。若将此温度下PH=11的苛性钠溶液a L与PH=1的稀硫酸b L混合(忽略混合后体积变化),若所得混合液为中性,则a :b= 。
(5)已知298K时, Ksp(CaCO3)=2.80×10-9, Ksp(CaSO4)=5.6×10-5 ,求此温度下该反应 的平衡常数K的数值为____
的平衡常数K的数值为____
参考答案:(1)3 mol/L,x=2(2)NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234 kJ·mol-1。(3)①25%;②增大。(4)大于;10:1。(5)2×104。
本题解析:(1)假设AB的物质的量为n,D的浓度为1mol/L,所以D的物质的量为2摩尔,则列式计算:
3A(g)+B(g)=xC(g)+2D(g)
起始物质的量 n n 0 0
改变物质的量 3 1 x 2
5分末的物质的量 n-3 n-1 x 2
(n-3)/(n-1)=3/4 解n=9摩尔, x÷2÷5=0.2 x=2,所以A在5分末的浓度为(9-3)/2="3" mol/L,x=2。(2)根据图像分析1摩尔二氧化氮和1摩尔一氧化碳反应放热为364-134=234kJ的热量,热化学方程式写为:NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234 kJ·mol-1。(3)①M的转化率为60%,则反应的M的物质的量浓度为1×60%=0.6 mol·L-1,根据反应方程式分析,N反应的物质的量浓度也为0.6 mol·L-1,则N的转化率=0.6/2.4=25%。②由于正反应为吸热,所以升温平衡正向移动,平衡常数增大。(4)因为常温下水的离子积常数为10-14,电离吸热,常数增大,说明平衡正向移动,温度升高,即温度大于25℃。在此温度下,pH=11的氢氧化钠溶液中氢氧根离子浓度=0.01 mol?L-1,pH=1的硫酸溶液中氢离子浓度为0.1 mol?L-1,弱酸碱混合后为中性,则氢离子和氢氧根离子物质的量相等,即体积比为10:1。(5)该反应的平衡常数=c(SO42-)/c(CO32-)= Ksp(CaSO4)/ Ksp(CaCO3)= 5.6×10-5/2.80×10-9=2×104。
考点:化学平衡计算,热化学方程式书写,化学平衡常数,酸碱混合。
本题难度:困难
3、填空题 我国某大型电解铜生产企业,其冶炼工艺中铜、硫回收率达到97%、87%。下图表示其冶炼加工的流程:

冶炼中的主要反应:Cu2S + O2 =" 2Cu" + SO2
(1)烟气中的主要废气是________________,从提高资源利用率和减排考虑,其综合利用方式是制___________。
(2)电解法炼铜时,阳极是____________(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式在电解槽_______________(填“阳极”或“阴极”的槽底,阴极的电极反应式是_________________________________________。
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
几种物质的溶度积常数(KSP):
物质
| Fe(OH)2
| Fe(OH)3
| Zn(OH)2
| Cu(OH)2
|
KSP
| 8.0×10-16
| 4.0×10-38
| 3.0×10-17
| 2.2×10-20
|
?
调节电解液的pH是除去杂质离子的常用方法。根据上表中溶度积数据判断,含有等物质的量浓度的Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是______________。
一种方案是先加入过量的H2O2,再调节pH到4左右。加入H2O2后发生反应的离子方程式为___________________________________________________________________________。
参考答案:(1)SO2(1分)?硫酸(1分)
(2)粗铜板(1分)?阳极(1分)? Cu2+ + 2e-=" Cu" (2分)
(3)Fe3+(2分)? 2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O(2分)
本题解析:(1)由题意可知烟气中主要废气为SO2,可回收用于制取H2SO4,变废为宝;(2)电解法炼铜时,粗铜板作阳极,纯铜板作阴极;金、银比铜难失去电子,不能在阳极反应,也不溶于电解液,沉底变为阳极泥;阴极反应式为Cu2+ + 2e-=" Cu" ;(3)溶度积越小的氢氧化物,其溶解度一般越小,越容易形成过饱和溶液而析出沉淀,读图可知,Fe3+最先沉淀,Fe2+最后沉淀;由电子守恒、电荷守恒、原子守恒原理配平可得:2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O。
本题难度:一般
4、填空题 已知氨水的电离程度与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(固)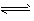 Mg2++2OH-①
Mg2++2OH-①
NH4++H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH-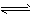 H2O③
H2O③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(固) Mg2++2OH-①
Mg2++2OH-①
NH4++OH-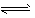 NH3·H2O②
NH3·H2O②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是____(填写编号)。
A.NH4NO3
B.CH3COONH4
C.Na2CO3
D.NH3·H2O
(2)请你说明丙同学作出该选择的理由_____________________。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 ____(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式______________。
参考答案:(1)B
(2)CH3COONH4溶液呈中性,滴入Mg(OH)2悬浊液,若 Mg(OH)2溶解,则说明乙同学解释正确,若Mg(OH)2不溶,则甲同学解释正确
(3)乙; Mg(OH)2+2NH4+=Mg2++2NH3·H2O
本题解析:
本题难度:一般
5、选择题 海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
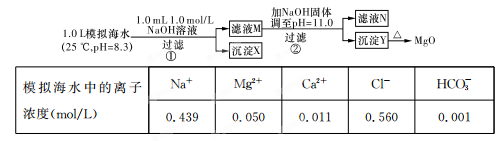
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。已知:KSp(CaCO3)=4.96×10-9;KSp(MgCO3)=6.82×10-6;KSp[Ca(OH)2]=4.68×10-6;KSp[Mg(OH)2]="5.61×10" -12。
下列说法不正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+和Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y只有Mg(OH)2
参考答案:C
本题解析:步骤①,从题给的条件,可知n(NaOH)=0.001mol,[即n(OH-)=0.001mol].依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001mol NaOH时,OH- 恰好与HCO3-完全反应:OH-+HCO3-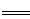 CO32-+H2O,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀Ca2++CO32-=CaCO3↓.所以沉淀物X为CaCO3,故A正确;步骤①中,由于CO32-只有0.001mol,反应生成CaCO3所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010mol·L-1,所以滤液M中同时存在着Ca2+和Mg2+,故B正确;步骤②,当滤液M中加入NaOH 固体,调至pH=11时,此时滤液中c(OH-)=1×10-3 mol·L-1.则Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成,Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成,又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,故C错误;步骤②中若改为加入4.2 g NaOH固体,则n(NaOH)=0.105mol,与0.05mol Mg2+反应:Mg2++2OH-=Mg(OH)2↓,生成0.05 molMg(OH)2,剩余0.005 mol OH-,由于Q[Ca(OH)2]=c(Ca2+)×(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,故D正确。sp的应用和计算,离子反应等。
CO32-+H2O,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀Ca2++CO32-=CaCO3↓.所以沉淀物X为CaCO3,故A正确;步骤①中,由于CO32-只有0.001mol,反应生成CaCO3所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010mol·L-1,所以滤液M中同时存在着Ca2+和Mg2+,故B正确;步骤②,当滤液M中加入NaOH 固体,调至pH=11时,此时滤液中c(OH-)=1×10-3 mol·L-1.则Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成,Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成,又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,故C错误;步骤②中若改为加入4.2 g NaOH固体,则n(NaOH)=0.105mol,与0.05mol Mg2+反应:Mg2++2OH-=Mg(OH)2↓,生成0.05 molMg(OH)2,剩余0.005 mol OH-,由于Q[Ca(OH)2]=c(Ca2+)×(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,故D正确。sp的应用和计算,离子反应等。
本题难度:一般