1、填空题 下表是几种常见弱酸的电离常数(25 ℃)。
酸
| 电离方程式
| 电离常数K
|
CH3COOH
| CH3COOH CH3COO-+H+ CH3COO-+H+
| 1.76×10-5
|
H2CO3
| H2CO3 H++HC H++HC
HC H++C H++C
| K1=4.4×10-7
K2=4.7×10-11
|
H2S
| H2S H++HS- H++HS-
HS- H++S2- H++S2-
| K1=1.3×10-7
K2=7.1×10-15
|
H3PO4
| H3PO4 H++H2P H++H2P
H2P H++HP H++HP
HP H++P H++P
| K1=7.1×10-3
K2=6.3×10-8
K3=4.2×10-13
|
回答下列问题:
(1)当温度升高时,K值 (填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系? 。
(3)若把CH3COOH、H2CO3、HC、H2S、HS-、H3PO4、H2P、HP都看成是酸,其中酸性最强的是 ,最弱的是 。
(4)多元弱酸是分步电离的,每一步都有相应的电离常数,对于同一种多元弱酸的K1、K2、K3之间存在着一定的规律,此规律是 ,产生此规律的原因是 。
参考答案: (1)增大
(2)K值越大,电离出的氢离子浓度越大,所以酸性越强
(3)H3PO4 HS-
(4)K1?K2?K3 上一级电离产生的H+对下一级电离起抑制作用
本题解析: (1)弱电解质的电离过程为吸热过程,所以升高温度,电离平衡向右移动,c(H+)、c(A-)增大,c(HA)减小,所以K值增大;
(2)K值越大,电离出的氢离子浓度越大,酸性越强;
(3)比较这几种粒子的电离常数可知,H3PO4酸性最强,HS-酸性最弱;
(4)由于上一级电离对下一级电离有抑制作用,使得上一级电离常数远大于下一级的电离常数。
考点:弱电解质的电离
本题难度:困难
2、选择题 常温下0.1mol?L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列正确是( )
A.该溶液中由水电离出的c(H+)=1×10-11mol?L-1
B.浓度均为0.1mol?L-1的HA和NaA溶液等体积混合后,若溶液呈酸性,则有:c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
C.0.1mol?L-1HA溶液与0.05mol?L-1NaOH溶液等体积混合后所得溶液中:c(A-)+c(HA)=c(Na+)
D.0.1mol?L-1HA溶液与0.05mol?L-1NaOH溶液等体积混合后所得溶液中:c(H+)+c(HA)=c(OH-)
参考答案:A、根据c(OH-)c(H+)=10-8和c(H+)×c(OH-)=10-14可知,溶液中c(H+)10-14c(H+)=108,解之得c(H+)=0.001mol/L,该溶液中由水电离出的
c(H+)=c(OH-)=Kw0.001mol/L=10-11mol/L,故A正确;
B、浓度均为0.1mol?L-1的HA和NaA溶液等体积混合后,若溶液呈酸性,,说明溶液中HA的电离程度大于A-离子的水解程度,则有c(Na+)>c(HA),故B错误;
C、0.1mol?L-1HA溶液与0.05mol?L-1NaOH溶液等体积混合后,根据物料守恒应有c(A-)+c(HA)=2c(Na+),故C错误;
D、0.1mol?L-1HA溶液与0.05mol?L-1NaOH溶液等体积混合后所得溶液中,根据溶液的电中性可知溶液中存在c(H+)+c(Na+)=c(OH-)+c(A-),根据物料守恒应有
c(A-)+c(HA)=2c(Na+),则有2c(H+)+c(A-)+c(HA)=2c(OH-)+2c(A-),即2c(H+)+c(HA)=2c(OH-)+c(A-),故D错误.
故选A.
本题解析:
本题难度:简单
3、选择题 根据下表信息,下列判断正确的是
酸
| 电离常数(常温下)
|
CH3COOH
| Ki=1.8×10-5
|
H2CO3
| Ki1=4.3×l0-7, Ki2= 5.6×10-11
|
H2S
| Ki1= 9.1×10-8, Ki2= 1.1×10-12
|
A.0.10mol/L的下列各溶液pH:Na2S<Na2CO3
B.HCO3-+CH3COOH→H2O+CO2↑+CH3COO-
C.硫化钠溶液可以与碳酸氢钠溶液反应
D.pH相同的CH3COOH、H2CO3、H2S,溶液浓度依次减小
参考答案:BC
本题解析:A.电离常数越大酸性越强,则根据电离平衡常数可知酸性是碳酸氢钠大于硫氢化钠,酸性越弱,酸根越容易水解,溶液的碱性越强,则0.10mol/L的下列各溶液pH:Na2S>Na2CO3,A错误;B.醋酸的酸性强于碳酸,则根据较强酸制备较弱酸可知HCO3-+CH3COOH→H2O+CO2↑+CH3COO-,B正确;C.酸性是碳酸氢钠大于硫氢化钠,则硫化钠溶液可以与碳酸氢钠溶液反应生成硫氢化钠和碳酸钠,C正确;D.酸性是CH3COOH>H2CO3>H2S,则pH相同的CH3COOH、H2CO3、H2S,溶液浓度依次增大,D错误,答案选BC。
考点:考查电离平衡常数的应用
本题难度:一般
4、选择题 常温下,对下列四种溶液的叙述正确的是
?
| ①
| ②
| ③
| ④
|
pH
| 10
| 10
| 4
| 4
|
溶液
| 氨水
| 氢氧化钠溶液
| 醋酸溶液
| 盐酸
|
A.四种溶液分别加水稀释10倍,pH变化最大的是①和④?
B.②、④两溶液相比,两者的kw相同
C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D.①、④两溶液按一定体积比混合,所得溶液中离子浓度顺序一定为: c(NH4+)>c(Cl-)>c(H+)> c(OH-)
参考答案:B
本题解析:①氨水是弱碱,当溶液稀释时,未电离的电解质分子会继续电离,使c(OH-)又略有增大,pH变化较小,③醋酸是弱酸当溶液稀释时,未电离的电解质分子会继续电离,使c(OH-)又略有增大,pH变化较小,而②氢氧化钠溶液和④的HCl都是强电解质,当加水稀释时,只有溶液的稀释作用,使离子的浓度减小,所以当稀释相同倍数时pH变化较大。因此稀释相同倍数时,pH变化最大的是②和④。错误。B.kw只与温度有关,②、④在相同的温度下,所以水溶液的两溶液kw相同。正确。C.向①加入少量的醋酸铵固体,对一水合氨的电离起抑制作用,所以溶液的pH均减小;向②加入少量的醋酸铵固体,铵根离子会与OH-离子结合形成一水合氨,使c(OH-)减小,所以溶液的pH均减小;向③中加入少量的醋酸铵固体后,由于增大了醋酸根离子的浓度,醋酸的电离平衡逆向移动,醋酸的电离程度减小,所以三种溶液的pH增大。错误。D.不符合电荷守恒的规律,应该是c(NH4+)>c(Cl-)> c(OH-) >c(H+)或者c(Cl-)>c(NH4+)>c(H+)>c(OH-)。错误。
本题难度:一般
5、选择题 夏天,鸡没有汗腺只能依赖“喘息”调节体温。鸡过度地呼出CO2,使下列平衡向左移动导致蛋壳变薄,使农场主和超市经营者蒙受经济损失。CO2(g)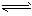 CO2 (aq),CO2(aq)+H2O
CO2 (aq),CO2(aq)+H2O 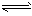 H2CO3 (aq) ;
H2CO3 (aq) ;
H2CO3 (aq) 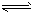 H+ (aq)+HCO3-(aq) ; HCO3- (aq)
H+ (aq)+HCO3-(aq) ; HCO3- (aq) 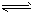 H+ (aq) +CO32- (aq) ;
H+ (aq) +CO32- (aq) ;
Ca2+ (aq) +CO32- (aq) 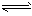 CaCO3 (s)(蛋壳)。澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚,这种饮料是
CaCO3 (s)(蛋壳)。澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚,这种饮料是
[? ]
A.淡盐水
B.碳酸水
C.蔗糖
D.澄清石灰水
参考答案:B
本题解析:
本题难度:简单