1、填空题 (10分)硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ. SO2+2H2O+I2===H2SO4+2HI
Ⅱ. 2HI H2+I2
H2+I2
Ⅲ. 2H2SO4===2SO2+O2+2H2O
(1) 分析上述反应,下列判断正确的是?。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2) 一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
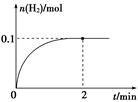
① 0~2 min内的平均反应速率v(HI)=?。
② 该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=?。
2HI(g)的平衡常数K=?。
③ 相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则?是原来的2倍。
a.平衡常数? b.HI的平衡浓度
c.达到平衡的时间? d.平衡时H2的体积分数
(3) 实验室用Zn和稀硫酸制取H2,反应时若加入少量下列试剂中的?,产生H2的速率将增大。
a.NaNO3?b.CuSO4? c.Na2SO4?d.NaHSO3
参考答案:(1)c ? (2) ①0.1 mol·(L·min)-1 ? ②64 ? ③b? (3) b
本题解析:(1)2SO2+O2+2H2O=2H2SO4是常温下自发进行的,所以2H2SO4===2SO2+O2+2H2O很难在常温下进行,a错误;SO2是还原剂HI是还原产物,所以SO2的还原性强于HI,b错误;三个反应的总反应为2H2O 2H2+O2,所以c正确,d错误。
2H2+O2,所以c正确,d错误。
(2)①v(HI)=
②根据图示可知,平衡时c(H2)=0.1mol/L,则c(I2)=0.1mol/L,c(HI)=0.8mol/L,所以K= 。
。
③若开始加入2molHI,则相当于将原容器增大2倍的压强,平衡不移动,但所有物质的浓度是原来的2倍,所以b正确。
(3)Zn能与CuSO4反应形成Cu—Zn原电池,加快反应速率,所以b正确。
点评:本题综合性强,但是难度不大,根据一般的解题规律很轻松解答。
本题难度:一般
2、选择题 将装有1mol NH3的密闭容器加热,部分NH3分解后达到平衡,此时混合气中NH3的体积分数为x%;若在同一容器中最初加入的是2mol NH3,密封、加热到相同温度,反应达到平衡时,设此时混合气体中NH3的体积分数为y%。则x和y的正确关系是
[? ]
A.x>y
B.x<y
C.x=y
D.x≥y
参考答案:B
本题解析:
本题难度:一般
3、选择题 在某固定容积的密闭容器中存在化学平衡:a A(g) b B(g)+c C(g),在温度不变的条件下,再充入一定量的A 物质,重新达到平衡时,下列判断中正确的是(?)
b B(g)+c C(g),在温度不变的条件下,再充入一定量的A 物质,重新达到平衡时,下列判断中正确的是(?)
A.若a=b+c时,B的物质的量分数变大
B.若a=b+c时,B的物质的量分数不变
C.若a>b+c时,A的转化率不变
D.若a<b+c时,A的转化率变小
参考答案:BD
本题解析:对于只有一种反应物的可逆反应,增加A的量,相当于增大体系的压强,平衡向正反应方向移动,但该反应质A的转化率的变化与气体物质的系数有关。①若a=b+c,A的转化率不变,反应混合物的含量保持不变,故A项错误,B项正确;②若a>b+c,A的转化率增大,故C项错误;③若a<b+c,A的转化率减小,故D项正确。
本题难度:一般
4、选择题 在500℃时,向甲容器中充入1mol?SO3,向相同容积的乙容器中充入1mol?SO2和0.5mol?O2.若甲容器保持容积不变,乙容器保持压强不变,分别达到平衡,下列说法正确的是( )
A.平衡时容器内的压强:甲>乙
B.平衡时容器内的压强:乙>甲
C.平衡时容器内O2的体积分数:乙>甲
D.平衡时容器内SO3的体积分数:甲>乙
参考答案:起始时,甲、乙两容器体积相同,在同温下,若保持乙容器体积不变,则两容器达到同一平衡状态,即等效平衡.而实际上乙是恒压容器,加入1mol SO2和0.5mol O2反应向正向进行,混合气体的总物质的量减小,活塞P下移,容器的体积减小.这一过程乙对甲相当于加压,平衡正移.因此,达平衡时,容器内压强:乙>甲;故A错误,B正确;
平衡正移,容器内SO3的体积百分数增大,则平衡时容器内SO3的体积分数乙>甲,O2的体积分数减小,则平衡时容器内O2的体积分数甲>乙,故C、D错误.
故选B.
本题解析:
本题难度:简单
5、简答题 无水氯化铝是一种重要的化工原料,利用明矾石[K2SO4?Al2(SO4)3?2Al2O3?6H2O]制备无水氯化铝的流程如下:
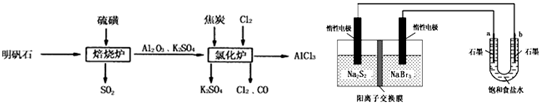
(1)焙烧炉中产生的SO2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为______;(用必要的文字简述).
(2)氯化炉中发生的主要反应为:2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是______.
(3)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)______.
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液?②氯化亚铁溶液?③硫氰化钾溶液?④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na2S2+NaBr3
Na2S4+3NaBr
①用惰性电极电解饱和食盐水的化学方程式为______.
②如图所示原电池放电时,电池中的Na+向______(填“左槽”或“右槽”)移动.左槽中发生的电极反应式为______.
③该原电池工作一段时间后,测得左槽中Na+物质的量由a?mol变为b?mol,则电解池中b电极上得到的气体在标准状况下的体积为______L(不考虑气体的损失).
参考答案:(1)酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H+)增大,pH减小,
故答案为:酸雨中的弱酸亚硫酸被氧化为强酸硫酸,使溶液中的c(H+)增大,pH减小;
(2)焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动,
故答案为:焦炭可消耗产物中的氧气,使c(O2)变小;且放出热量,温度升高,导致平衡向正反应方向移动;
(3)取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应,
故答案为:取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应;否则,二者未完全反应;
(4)①惰性电极电解饱和氯化钠溶液,生成氢气、氯气、氢氧化钠,电解总反应式为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑;
②原电池左侧发生氧化反应,为负极,右侧为正极,电解质溶液钠离子向正极移动,即向右槽移动;
由反应2Na2S2+NaBr3?放电?.?Na2S4+3NaBr可知,左侧S22-放电生成S42-,电极反应式为:2S22--2e-=S42-,
故答案为:右槽;2S22--2e-=S42-;
③该原电池工作一段时间后,测得左槽中Na+物质的量由a?mol变为b?mol,则转移电子的物质的量为(a-b)mol,电解池中b电极连接电源的正极,为阳极,得到的气体为氯气,根据电子转移守恒可知氯气的物质的量为你(a-b)mol2,故生成氯气的体积=(a-b)mol2×22.4L/mol=11.2(a-b)L,
故答案为:11.2(a-b).
本题解析:
本题难度:一般