1、填空题 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)
参考答案:
本题解析:
本题难度:困难
2、选择题 已知浓度商(Qc)表示任意状态下反应体系中物质的浓度关系,其表达式与化学平衡常数的表达式相同。保持温度和体积不变,可逆反应:A(s) + 2B(g) 2C(g) + D(g) △H<0, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是
2C(g) + D(g) △H<0, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是
容器
| 体积
| 起始物质
| 平衡时C的
物质的量
| 平衡时B的
体积分数
| 平衡常数
|
甲
| 1L
| 1molA+2molB
| 1mol
| φ甲
| K甲
|
乙
| 1L
| 4molC+2molD
| n1 mol
| φ乙
| K乙
|
丙
| 2L
| 4molC+2molD
| n2 mol
| φ丙
| K丙
|
A.在建立平衡的过程中,甲的Qc逐渐减小,乙和丙的Qc逐渐增大
B.K甲=K丙>K乙
C.升高甲的温度,可使φ甲=φ乙
D.n1=1.6,n2=2
参考答案:C
本题解析:A、QC=c(C)2c(D)/c(B)2,甲从正反应开始,所以B的浓度逐渐减小,C、D的浓度逐渐增大,所以甲的QC逐渐增大,与乙、丙从逆反应开始,与甲相反,则QC逐渐增大,错误;B、三者的温度相同,所以平衡常数相等,错误;C、甲与丙是等效平衡,B的体积分数相等;乙的浓度是丙的2倍,相当于将丙缩小体积,则压强增大,而增大压强,平衡逆向移动,所以B的体积分数增大,则乙中B的体积分数大于甲,所以升高甲的温度,平衡逆向移动,则B的体积分数增大,可以使φ甲=φ乙,正确;D、因为三者的平衡常数相等,甲中C的物质的量是1mol,则D的物质的量是0.5mol,B的物质的量是1mol,所以平衡常数K=0.5,因为甲与丙是等效平衡,丙的物质的量是甲的2倍,所以n2=2;所以乙的平衡常数也是0.5mol,若n1=1.6,则D的物质的量是0.8mol,B的物质的量是2-1.6=0.4mol,计算 c(C)2c(D)/c(B)2>0.5,说明反应未达平衡状态,错误,答案选C。
考点:考查化学平衡的移动,等效平衡的应用
本题难度:困难
3、填空题 (14分)合成氨是人类科学技术上的一项重大突破。
(1)NH3经一系列反应可以得到HNO3和NH4NO3。
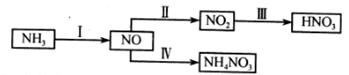
II中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。
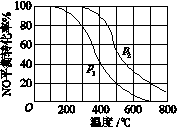
①随温度升高,该反应平衡向__________(选填“正反应”或“逆反应”)方向移动。
②比较P1、P2的大小关系:______________。
(2)一种工业合成氨的简易流程图如下:
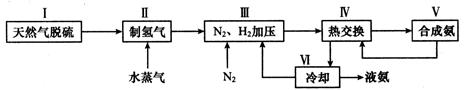
步骤II中制氢气原理如下:
a.CH4(g)+H2O(g) CO(g)+3H2(g) △H =" +206.4" kJ/mol
CO(g)+3H2(g) △H =" +206.4" kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) △H =" —41.2" kJ/mol
CO2(g)+H2(g) △H =" —41.2" kJ/mol
①对于反应a而言,增大CH4的浓度,达新平衡时H2的体积分数_ _ __增大(选填“一定”或“不一定”)。
②利用反应b,将CO进一步转化,可提高H2产量。若在500 ℃时,把等浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005 mol·L-1、c(H2)=0.015 mol·L-1,则CO的平衡转化率为 。
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,④简述一种本流程中可以提高合成氨原料总转化率的方法 。
参考答案:19.(14分)(1)①逆反应 ②P2>P1 (2)①不一定 ②3/4或75% (3分)
③Ⅳ ④对原料气加压(或分离液氨后,未反应的N2、H2循环使用 )(3分)
本题解析:(1)①由图像可知,随温度升高,NO的平衡转化率降低,说明该反应平衡向逆反应方向移动,2NO(g)+O2(g) 2NO2(g),增大压强,平衡正向移动,NO的平衡转化率升高,所以P2>P1;
2NO2(g),增大压强,平衡正向移动,NO的平衡转化率升高,所以P2>P1;
(2)①CH4(g)+H2O(g) CO(g)+3H2(g) △H =" +206.4" kJ/mol增大CH4的浓度,达新平衡时H2的体积分数不一定增大,②设CO的转化量为x CO + H2O
CO(g)+3H2(g) △H =" +206.4" kJ/mol增大CH4的浓度,达新平衡时H2的体积分数不一定增大,②设CO的转化量为x CO + H2O CO2 + H2
CO2 + H2
开始量(mol)0.02
转化量(mol) x x x x
平衡量(mol)0.005 0.015 0.015
可得CO转化率=0.015mol÷0.02mol×100%=75%
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是Ⅳ;④提高合成氨原料总转化率方法是使合成氨平衡正向移动,所以对原料气加压或分离液氨后,未反应的N2、H2循环使用 。
考点:考查合成氨的工艺流程。
本题难度:困难
4、选择题
一刚性密闭容器内部有一不漏气且可滑动的活塞将容器分成左右两个室,左室内充入一定体积的CO和
H2O气体,右室充入SO2和O2两种气体,且SO2和O2的物质的量之比为2:1,左右两室内各可发生如下反应:
左室 CO(气)+H2O(气)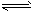 CO2(气)+H2(气) △H<0
CO2(气)+H2(气) △H<0
右室 2SO2(气)+O2(气)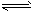 2SO3(气) △H<0 反应开始时活塞停留在离左端点3/7处,反应在恒温下进行,当达平衡状态时,活塞处于容器中间。下列叙述正确的是
2SO3(气) △H<0 反应开始时活塞停留在离左端点3/7处,反应在恒温下进行,当达平衡状态时,活塞处于容器中间。下列叙述正确的是
[? ]
A.右室气体反应前后的压强之比为4:3
B.反应达平衡时气体SO2的转化率为75%
C.平衡时再向左室中充入与原物质的量之比相同的CO和H2O气体,达平衡时,CO的物质的量分数不变,SO2的物质的量分数变小
D.若原容器中左右两室起始时充入的各物质的量均为原来的两倍,达平衡时,活塞相对与中间位置将偏左
参考答案:BC
本题解析:
本题难度:一般
5、选择题 在523K时,有以下反应:2HCl(g)+ CrO3(g) CrO2Cl2(g)+H2O(g) +Q (Q>0),反应进行至第5min时,改变某个条件,当反应进行至第10 min时,发现生成CrO2Cl2(g)的速率增大,CrO2Cl2的百分含量也增大,则改变的条件不可能是
CrO2Cl2(g)+H2O(g) +Q (Q>0),反应进行至第5min时,改变某个条件,当反应进行至第10 min时,发现生成CrO2Cl2(g)的速率增大,CrO2Cl2的百分含量也增大,则改变的条件不可能是
A.加热
B.使用催化剂
C.加压
D.分离出水气