1、填空题 利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应。常用来生产液氨和氨水。
完成下列填空:
(1)如图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ。请写出合成氨的热化学方程式____________________。
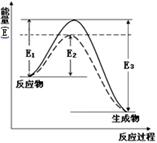
(热量用E1、E2或E3表示)。该图中的实线与虚线部分是什么反应条件发生了变化?
(2)在一定温度下,若将4a?mol?H2和2amol?N2放入VL的密闭容器中,5分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为__________摩尔/(升?秒)。若此时再向该容器中投入a?mol?H2、amol?N2和2amol?NH3,判断平衡移动的方向是_____(填“正向移动”“逆向移动”或“不移动”)
(3)液氨和水类似,也能电离:2NH3 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
(4)工厂生产的氨水作肥料时需要稀释。用水稀释0.1mol/L稀氨水时,溶液中随着水量的增加而减少的是
A.c(NH4+)/c(NH3?H2O)
B.c(NH3?H2O)/c(OH-)
C.c(H+)/c(NH4+)
D.c(OH-)/c(H+)
参考答案:(1)N2(g)+3H2(g)  ?2NH3(g)+2(E3-E1)kJ/mol; 催化剂
?2NH3(g)+2(E3-E1)kJ/mol; 催化剂
(2)0.01a/v ; 正向移动
(3)=;c(NH3)>c(NH2-)>c(Na+)>c(NH4+)
(4)B、D
本题解析:
(1)根据题意及图像可知该反应的热化学方程式为N2(g)+3H2(g) 2NH3(g)+2(E3-E1)kJ/mol;改变某一条件,降低了反应的活化能,使很多原来不能反应的分子变为活化分子,提高了活化分子的百分比率,反应速率加快。这是催化剂的作用。
2NH3(g)+2(E3-E1)kJ/mol;改变某一条件,降低了反应的活化能,使很多原来不能反应的分子变为活化分子,提高了活化分子的百分比率,反应速率加快。这是催化剂的作用。
(2)5分钟后测得N2的转化率为50%,则?n(N2)=amol,则?n(H2)=3amol,所以V(H2)= (?n(H2)÷v)÷ ?t="3amol÷" Vl÷5min×60s/min=0.01a/vmol/(L·s).根据反应方程式N2(g)+3H2(g)  2NH3(g)可知达平衡时各种物质的物质的量为n(N2)=amol;n(H2)="amol" n(NH3)=2amol.若在此时再向该容器中投入a?mol?H2、amol?N2和2amol?NH3。相当于将容器的容积压缩至原来的一半。由于压强增大的影响大于浓度增大的影响,所以增大压强。化学平衡向气体体积减小的反应方向移动。由于该反应的正反应是气体体积减小的反应,所以在此时再向该容器中投入a?mol?H2、amol?N2和2amol?NH3,化学平衡向正反应方向移动。
2NH3(g)可知达平衡时各种物质的物质的量为n(N2)=amol;n(H2)="amol" n(NH3)=2amol.若在此时再向该容器中投入a?mol?H2、amol?N2和2amol?NH3。相当于将容器的容积压缩至原来的一半。由于压强增大的影响大于浓度增大的影响,所以增大压强。化学平衡向气体体积减小的反应方向移动。由于该反应的正反应是气体体积减小的反应,所以在此时再向该容器中投入a?mol?H2、amol?N2和2amol?NH3,化学平衡向正反应方向移动。
(3)离子积K只与温度有关,而与其它条件无关。由于温度没变,所以K不会变化,还等于2×10-30。②在液氨中存在电离平衡2NH3 NH4++ NH2-。若将少量金属钠投入液氨中,发生反应2Na+ 2NH4+=2NaNH2+H2↑.由于消耗了NH4+,破坏了电离平衡,促使NH3向电离的方向移动。最终达到平衡。由于NH3的电离程度是很微弱的。所以完全反应后所得溶液中各微粒的浓度大小关系为:c(NH3)>c(NH2-)>c(Na+)>c(NH4+)。
NH4++ NH2-。若将少量金属钠投入液氨中,发生反应2Na+ 2NH4+=2NaNH2+H2↑.由于消耗了NH4+,破坏了电离平衡,促使NH3向电离的方向移动。最终达到平衡。由于NH3的电离程度是很微弱的。所以完全反应后所得溶液中各微粒的浓度大小关系为:c(NH3)>c(NH2-)>c(Na+)>c(NH4+)。
(4)在氨水中存在电离平衡:NH3·H2O NH4++OH-。用水稀释0.1mol/L稀氨水时。若平衡不移动,c(NH3?H2O)、c(NH4+)、c(OH-)都减小。但加水稀释时平衡向电离的方向移动,c(NH3?H2O)进一步减小,c(NH4+)、c(OH-)的浓度在减小的基础上又略有增加。但由于在溶液中存在水的电离平衡H2O
NH4++OH-。用水稀释0.1mol/L稀氨水时。若平衡不移动,c(NH3?H2O)、c(NH4+)、c(OH-)都减小。但加水稀释时平衡向电离的方向移动,c(NH3?H2O)进一步减小,c(NH4+)、c(OH-)的浓度在减小的基础上又略有增加。但由于在溶液中存在水的电离平衡H2O H+ +OH-。c(H+)·c(OH-)=Kw,c(OH-)减小,所以c(H+)增大。所以c(NH4+)/c(NH3?H2O)增大;A错误。(NH3?H2O)/c(OH-)减小;B正确。C.c(H+)/c(NH4+)增大。错误。D.c(OH-)/c(H+)减小,正确。故选项为B、D。
H+ +OH-。c(H+)·c(OH-)=Kw,c(OH-)减小,所以c(H+)增大。所以c(NH4+)/c(NH3?H2O)增大;A错误。(NH3?H2O)/c(OH-)减小;B正确。C.c(H+)/c(NH4+)增大。错误。D.c(OH-)/c(H+)减小,正确。故选项为B、D。
本题难度:一般
2、选择题 已知,碳在不足量的氧气中燃烧生成一氧化碳,放出热量;一氧化碳在氧气中能继续燃烧生成二氧化碳,放出热量。反应方程式分别为( )
2C(s)+O2(g)(不足) 2CO(g);
2CO(g);
2CO(g)+O2(g)(充足) 2CO2(g)
2CO2(g)
在其他条件相同时,下列说法错误的是
A.12gC所具有的能量一定高于28gCO所具有的能量
B.56gCO和32gO2所具有的总能量一定高于88gCO2所具有的总能量
C.12gC和32gO2所具有的总能量一定高于44gCO2所具有的总能量
D.将相同质量的碳燃烧,生成CO2比生成CO放出的热量多
参考答案:A
本题解析:化学反应发生后放出热量,则反应物的总能量一定高于生成物的总能量,所以,选项B正确。由于碳在不足量的氧气中燃烧生成一氧化碳,放出热量,一氧化碳在氧气中能继续燃烧生成二氧化碳,也放出热量,所以,C与O2反应生成CO2肯定放出热量,根据C(s)+O2(g)(充足) CO2(g)和反应放出热量分析,选项C正确。若反应2C(s)+O2(g)(不足)
CO2(g)和反应放出热量分析,选项C正确。若反应2C(s)+O2(g)(不足) 2CO(g)放出的热量为?H1,反应2CO(g)+O2(g)
2CO(g)放出的热量为?H1,反应2CO(g)+O2(g) 2CO2(g)放出的热量为?H2,将这两个化学方程式相加得反应:2C(s)+2O2(g)(充足)
2CO2(g)放出的热量为?H2,将这两个化学方程式相加得反应:2C(s)+2O2(g)(充足) 2CO2(g),放出的热量为:?H1+?H2>?H1,D正确。选项A不正确,只能说“12gC和16gO2所具有的总能量一定高于28gCO所具有的总能量”,而“12gC所具有的能量不一定高于28gCO所具有的能量”。
2CO2(g),放出的热量为:?H1+?H2>?H1,D正确。选项A不正确,只能说“12gC和16gO2所具有的总能量一定高于28gCO所具有的总能量”,而“12gC所具有的能量不一定高于28gCO所具有的能量”。
故选A。
点评:(1)对于某个确定的化学反应,放出或吸收的热量与反应物的用量有关。
(2)对于一定质量的某种物质燃烧后,生成“中间产物”时放出的热量,一般比生成最终产物放出的热量小,且总能量等于各段反应放出的能量之和。
本题难度:简单
3、选择题 实验室制取下列气体,其反应放热的是(?)
A.氯化铵和氢氧化钙制氨气
B.由乙醇制C2H4
C.由电石制C2H2
D.由氯酸钾制O2
参考答案:C
本题解析:略
本题难度:简单
4、选择题 当两个原子形成共价键时,将
[? ]
A.吸收能量
B.放出能量
C.可能吸收能量也可能放出能量
D.能量不会改变
参考答案:B
本题解析:
本题难度:简单
5、选择题 对于Zn(s)+H2SO4(l)==ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是(? )
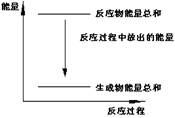
A.反应过程中能量关系可用上图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池锌为负极
D.若将其设计为原电池当有32.5g锌溶解时,正极F放出气体一定为11.2L
参考答案:D
本题解析:根据图像可知,反应物的总能量高于生成物的总能量,所以是放热反应。而锌与稀硫酸的反应是就是放热反应,所以选项A正确。反应热和化学计量数有关系,B正确。该反应是氧化还原反应,所以能设计成原电池,C正确。32.5g锌失去32.5g÷65g/mol×2=1.0mol,所以生成氢气是0.5mol,但体积不一定是11.2L,选项D不正确,答案选D。
本题难度:一般