1、选择题 利用相关数据作出的推理或判断一定正确的是
A.用弱酸的电离常数比较相同条件下强碱弱酸盐溶液的碱性强弱
B.用物质的熔沸点数据推断物质的晶体类型
C.根据溶液的pH判断该溶液的酸碱性
D.根据焓变数据判断反应能否自发进行
参考答案:A
本题解析:B:金属晶体的熔沸点范围很大,甚至一些分子晶体的熔沸点都高于它,但钨的熔沸点特别高,原子晶体都没有它高。C:溶液的酸碱性决定于溶液中c(H+)与c(OH—)的相对大小,与pH没有直接的关系;D:自发反应主要决定于自由能的大小△G=△H-T△S
本题难度:简单
2、选择题 甲图是NO2(g)+CO(g)

CO2(g)+NO(g)反应过程能量变化示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如乙图.下列有关说法正确的是( )

A.该反应的焓变△H=+234kJ/mol
B.若X表示反应时间,则Y表示的可能是混合气体的密度
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
参考答案:从能量变化图可知,反应物能量高,生成物能量低,所以该反应为放热反应,△H为“-”,故A错误;
B、因反应过程中体积不变,根据ρ=mv可知,ρ不变,不符合图象,故B错误;
C、根据平衡移动原理,升高温度平衡向吸热方向移动,即向逆反应方向移动,所以CO2的物质的量浓度降低,故C正确;
D、根据平衡移动原理,增大CO的浓度,可提高NO2的转化率,图示转化率降低,故D错误.
故选C.
本题解析:
本题难度:简单
3、填空题 (6分)氨在国民经济中占有重要的地位,请参与下列探究
(1)已知在400℃时,2NH3(g)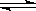 N2 (g)+ 3H2(g) (△H>0)的平衡常数K=2,
N2 (g)+ 3H2(g) (△H>0)的平衡常数K=2,
①400℃时,N2 (g)+ 3H2(g)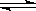 2NH3(g)的K=?(填数值)。
2NH3(g)的K=?(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(NH3)正?V(NH3)逆(填:>、<、=、不能确定)。
(2)已知: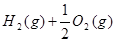 =H2O(l)?△H=—285.8 kJ·
=H2O(l)?△H=—285.8 kJ· ?…①
?…①
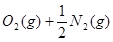 ?=NO2(g)?△H=+33.9 kJ·
?=NO2(g)?△H=+33.9 kJ· ?…②?
?…②?
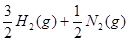 ?=NH3(g)?△H=—46.0 kJ·
?=NH3(g)?△H=—46.0 kJ· ?…③
?…③
H2O(l)=H2O(g)?△H=+44 kJ· ?…④
?…④
则表示NH3燃烧热的热化学方程式为?
参考答案:(1)①? 1/2?;②?=
(2)NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol
本题解析:(1)①根据平衡常数的表达式可知,逆反应的平衡常数是正反应的平衡常数的倒数,因此K=0.5。
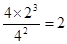 ②此时N2、H2、NH3的物质的量浓度分别是(mol/L)4、2、4,所以?,因此正逆反应速率相等。
②此时N2、H2、NH3的物质的量浓度分别是(mol/L)4、2、4,所以?,因此正逆反应速率相等。
(2)燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以根据盖斯定律可知,①×3/2-③即得到NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l),所以反应热是—285.8 kJ· ×1.5+46.0 kJ·
×1.5+46.0 kJ· =-382.7 kJ/mol,所以热化学方程式为NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol。
=-382.7 kJ/mol,所以热化学方程式为NH3(g)+3/4O2(g)= 1/2N2(g)+3/2H2O(l);△H=-382.7 kJ/mol。
本题难度:一般
4、选择题 已知热化学方程式:2SO2(g)+O2(g) 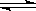 ?2SO3(g);ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
?2SO3(g);ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量
B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ
C.增大压强或升高温度,该平衡都向逆反应方向移动
D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应放热Q kJ,则此过程中有2 mol SO2(g)被氧化
参考答案:D
本题解析:A 错误,此反应是放热反应,2 mol SO2(g)和1 mol O2(g)所具有的能量大于2 mol SO3(g)所具有的能量
B 错误,此反应是可逆反应,2 mol SO2(g)和1 mol O2(g)未反应彻底,放出热量小于Q kJ
C 错误,增大压强平衡右移
D 正确,当反应放热Q kJ时,肯定有2mol SO2(g)参加反应,即被氧化。
本题难度:一般
5、填空题 (4分)(1)下列反应中,属于放热反应的是?,属于吸热反应的是?。
①燃烧反应②炸药爆炸③酸碱中和反应④二氧化碳通过炽热的碳
⑤食物因氧化而腐败⑥Ba(OH)2·8H2O与NH4Cl反应⑦铁粉与稀盐酸反应
(2)写出(1)中⑥的化学方程式?。
参考答案:(1)①②③⑤⑦?④⑥?(2)Ba(OH)2·8H2O +2NH4Cl ==BaCl2 +2NH3 +10H2O
本题解析:略
本题难度:简单