1、填空题 原子序数为13的元素位于元素周期表中第______周期、______族,其原子结构示意图为______.
2、选择题 某元素原子最外层上只有2个电子,该元素一定是
[? ]
A.金属元素
B.ⅡA族元素
C.稀有气体元素
D.无法确定
3、选择题 短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍.下列说法正确的是( )
A.Z元素形成的某种氧化物能使品红溶液褪色
B.X和Z的最高价氧化物对应的水化物都是弱酸
C.X与Y元素形成的化合物的相对分子质量是100g?mol-1
D.Y元素形成的单质能在氧气中燃烧但不能在二氧化碳中燃烧
4、简答题 A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M.1molM中含有42mol电子.回答下列问题:
(1)E元素在周期表中的位置:______周期______族;化合物M中含有的化学键类型有______;用电子式表示化合物A2C的形成过程:______
(2)比较B、C、E形成的气态氢化物的稳定性(用化学式表示):______>______>______;写出C与A形成的18e-化合物的电子式______;
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式:______;
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则负极上的电极反应式为______.
5、简答题 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
请回答下列问题(填空时用实际符号):
(1)C的元素符号是______;元素F在周期表中的位置______.
(2)B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物?B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为______,其固体时的晶体类型是______.
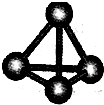
(3)最近意大利罗马大学的FuNvio?Cacace等人获得了极具理论研究意义的C4分子.C4分子结构如图所示,已知断裂lmolC-C吸收167kJ热量,生成Imo1C=C放出942kJ热量.根据以上信息和数据,下列说法正确的是______.
①C4属于一种新型的化合物
②C4沸点比P4(白磷)低
③lmol?C4气体转变为C2吸收882kJ热量
④C4与C2互为同素异形体
⑤C4稳定性比P4(白磷)差
⑥C4属于原子晶体
⑦C4和P4?(白磷)的晶体都属于分子晶体
⑧C4与C2互为同分异构体
(4)C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式为______,其空间构型为______.
(5)为了除去化合物乙(A2ED4);)稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为:______
(6)E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似.对此以下说法正确的是______.
a.E2F2的结构式为:F-E-E-F
b.E2F2为含有极性键?和非极性键的非极性分子
c.E2Br2与E2F2结构相似,熔沸点:E2Br2>E2F2
d.E2F2与H2O反应的化学方程式可能为:2E2F2+2H2O=EO2↑+3E↓+4HF
(7)举出一种事实说明E与F的非金属性强弱(用化学方程式或用语言文字表达均可):______.