1、简答题 有四组物质,它们的沸点(℃,P=1.01×105Pa)如下表所示:
| ① | He-268.8 | Ne-249.5 | Ar(x) | Kr-151.7
②
F2-187.0
Cl2-33.6
(a)58.7
I2-184.0
③
HF(Y)
HCl-84.0
HBr-67.0
HI-35.3
④
H2O(Z)
H2S-60.2
(b)-42.0
H2Te-1.8
|
试根据上表回答下列问题:
(1)物质b的分子式为:______,物质______(填a或b)易溶于苯.
(2)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是______.
(3)上表中,______和______两种物质的沸点较同系列其它物质反常,反常的主要原因是______.
参考答案:(1)第VIA主族元素从上到下分别为:O、S、Se、Te,则物质b的分子式为:H2Se;a为Br2,是非极性分子,易溶于有机溶剂苯,b为H2Se,是极性分子,难溶于苯,故a易溶于苯;
故答案为:H2Se;a;
(2)由表中数据判断沸点的变化规律:结构和组成相似的物质,其沸点随相对分子质量的增大而升高;
故答案为:结构和组成相似的物质,其沸点随相对分子质量的增大而升高;
(3)分子间能形成氢键的物质熔沸点较高,HF、H2O分子之间存在较强的氢键而其他氢化物分子间只存在较弱的范德华力,所以HF、H2O的沸点较同系列其它物质反常;
故答案为:HF、H2O;HF、H2O分子之间存在较强的氢键而其他氢化物分子间只存在较弱的范德华力.
本题解析:
本题难度:一般
2、选择题 食盐晶体如下图所示。在晶体中,·表示Na+,o表示Cl-。已知食盐的密度为r g/cm3,NaCl摩尔质量M g/mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是

A.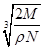 cm
cm
B.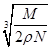 cm
cm
C.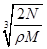 cm
cm
D.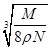 cm
cm
参考答案:B
本题解析:小立方体的每个顶点离子为8个小立方体共用,据均摊法,一个小立方体含Cl-为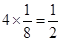 , Na+为
, Na+为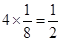 ,即一个晶胞中有(
,即一个晶胞中有(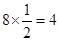 )4个Na+,4个Cl-,而一个晶胞的体积可用晶胞的棱长a表示,为a3。
)4个Na+,4个Cl-,而一个晶胞的体积可用晶胞的棱长a表示,为a3。
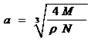 。故选B。
。故选B。
点评:本题考查了根据晶胞结构确定化学式,难度不大,利用均摊法即可分析解答本题。
本题难度:一般
3、填空题 甲烷、甲醇、肼(N2H4)、氨和氢气等都可作为燃料电池的燃料。
(1)与甲醇互为等电子体的有机物分子式为:_________________, 甲醇的熔、沸点比甲烷的熔、沸点高,其主要原因是:______________________
(2)N2H4中N-N键键能__________(填“>”或“<” “=”) CH3CH3中C-C键键能,工业上将NH3或
(CH3)2CO与氯气反应后水解制取N2H4,(CH3)2CO中碳原子轨道的杂化类型为:_________、________,
1 mol(CH3)2CO中的π键数目为:_________。
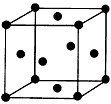
(3)用钛锰储氢合金储氢,与高压氢气钢瓶相比,具有重量轻、体积小的优点。锰原子外围电子排布式为:____________。金属钛的晶胞是面心立方结构(如图),则钛晶体的1个晶胞中钛原子数为:
________,钛原子的配位数为:________。
参考答案:(1)CH3SH;甲醇分子之间有氢键
(2)<;sp3杂化;sp2杂化;NA或6.02×1023
(3)3d54s2;4;12
本题解析:
本题难度:一般
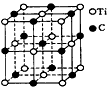
4、选择题 最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为
?[? ]
A.TiC
B.Ti13C14
C.Ti4C7
D.Ti14C13
参考答案:D
本题解析:
本题难度:一般
5、填空题 如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
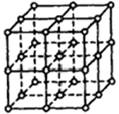
(1)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有?个。
(2)已知食盐晶体的密度为2.2g/cm3,阿伏加德罗常数为6.02×1023mol-1。食盐晶体中两个距离最近的钠离子中心间的距离为?cm。计算过程如下:
?
?。
参考答案:12? 4×10 -8cm
本题解析:略
本题难度:简单
|