1、选择题 下列说法正确的是(? )
A.两种元素组成的分子中一定只有极性键
B.原子晶体中共价键越强,熔点越高
C.晶体中分子间作用力越大,分子越稳定
D.由极性共价键结合的分子一定是极性分子
参考答案:B
本题解析:略
本题难度:简单
2、选择题 某物质有以下性质:①是电解质,②溶解时有化学键的破坏,③熔化时没有化学键的破坏,则该物质固态时属于
A.原子晶体
B.离子晶体
C.分子晶体
D.金属晶体
参考答案:C
本题解析:熔化时没有化学键的破坏说明不是离子、原子晶体,属于电解质,排除金属晶体,综合分析应为分子晶体。
本题难度:简单
3、选择题 下列固体属于离子晶体的是
A.石墨
B.氯化钠
C.干冰
D.铁
参考答案:B
本题解析:离子间通过离子键形成的晶体是离子晶体,因此选项B正确,石墨是混合型的,干冰是分子晶体,铁是金属晶体,答案选B。
本题难度:简单
4、填空题 (11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
元素
| 相关信息
|
T
| T原子所处的周期数、族序数分别与其原子序数相等
|
X
| X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同
|
Z
| Z的基态原子价电子排布为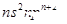
|
Q
| 在该元素所在周期中,Q的基态原子的第一电离能最小
|
R
| 3p能级上有1个电子
|
W
| W的一种核素的质量数为65,中子数为36
|
(1)X、Y、Q三种元素的电负性由大到小的顺序是?(用元素符号表示)。
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要?(填“高”、“低”)。
(3)W2+的核外电子排布式为?。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是?
A.氧化剂是O2? B.HO2在碱中不能稳定存在
C.氧化产物是HO2? D.1 molW参加反应有1 mol电子发生转移
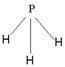
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为?(填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g)?2R2Z3(s)?△H=-2835.9 kJ/mol
4R(s)+2Z3(g)?2R2Z3(s)?△H=-3119.1 kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=?.
参考答案:1)N>C>Na?(2)高?(3)[Ar]3d9或1s22s22p63s23p63d9;C
(4)sp3?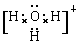 ?
? ,?极性? 2F2+2H2O=4HF+O2
,?极性? 2F2+2H2O=4HF+O2
(5)+47.2 kJ/mol(2分)
本题解析:根据元素的结构及其性质可知,T、X、Y、Z、Q、R、W分别是H、C、N、O、Na、Al、Cu。
(1)非金属性越强,电负性越大,所以X、Y、Q三种元素的电负性由大到小的顺序是N>C>Na。
(2),晶体结构与金刚石类似,石墨是原子晶体。由于碳原子半径大于氮原子半径,原子半径越小,共价键越强,所以该晶体的熔点大于金刚石的。
(3)根据构造原理可知,铜离子的电子排布式为[Ar]3d9或1s22s22p63s23p63d9。根据方程式可知,氧气是氧化剂,所以HO2是还原产物,选项C不正确,其余都是正确的,答案选C。
(4)A为5原子核的+1价阳离子,则A是NH4+,氮原子是sp3杂化。B为4原子核的+1价阳离子,则B是H3O+,其电子式为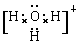 。C为4个原子核构成的分子,则C是氨气,所以与氨气互为等电子体的分子可以是PH3,其结构式为
。C为4个原子核构成的分子,则C是氨气,所以与氨气互为等电子体的分子可以是PH3,其结构式为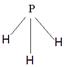 。D是双氧水,属于极性分子。E应该是是单质氟,和水反应的方程式为2F2+2H2O=4HF+O2。
。D是双氧水,属于极性分子。E应该是是单质氟,和水反应的方程式为2F2+2H2O=4HF+O2。
(5)考查盖斯定律的应用。①-②即得到3Z2(g)?2Z3(g)?△H=+283.2 kJ/mol。所以16g Z2(g)完全转化为Z3(g)的△H=+283.2 kJ/mol÷6=+47.2 kJ/mol。
本题难度:一般
5、选择题 下列物质的沸点(或固体的熔点)前者高于后者的是( )
A.新戊烷、异戊烷
B.苯酚、苯酚钠
C.乙酸、丙酸
D.硬脂酸和油酸
参考答案:A、新戊烷、异戊烷互为同分异构体,支链越多,沸点越低,则沸点前者小于后者,故A错误;
B、苯酚为分子晶体,苯酚钠为离子晶体,离子晶体的沸点高于分子晶体的沸点,则沸点前者小于后者,故B错误;
C、同系物中含有的碳原子个数越多,沸点越高,丙酸中碳原子数多,沸点高,则沸点前者小于后者,故C错误;
D、因分子晶体中,相对分子质量大的沸点高,硬脂酸(C17H35COOH)的相对分子质量大于油酸(C17H33COOH),故D正确;
故选D.
本题解析:
本题难度:简单