|
高考化学知识点归纳《金属的腐蚀与防护》试题预测(2020年最新版)(四)
2021-02-18 04:51:24
【 大 中 小】
|
1、填空题 (8分)用:NaCl做原料可以得到多种产品。
(1)工业上由NaCI制备金属钠的化学方程式是?。
(2)实验室用惰性电极电解100mL 0.1mol/LNaCl溶液。写出阳极的电极反应方程式:
?。
(3)某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl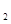 被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是 被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
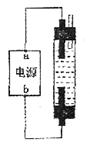
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极"b为阳极;HClO和NaCl
| 假设最后所得溶液中仅含一种溶质,则整个过程用一个化学方程式表示为:
?。
参考答案:

本题解析:略
本题难度:一般
2、选择题 下列事实中,与电化学腐蚀无关的是(?)
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀。
B.在空气中,金属银的表面生成一层黑色物质
C.为保护海轮的船壳,常在船壳上镶入锌块。
D.镀银的铁质品,镀层部分受损后,露出的铁表面更易被腐蚀。
参考答案:B
本题解析:选项B中是银的化学腐蚀,而不是电化学腐蚀,其余都是和电化学腐蚀有关系的,答案选B。
本题难度:简单
3、选择题 下列叙述正确的是( )

①装置甲可防止铁钉生锈;②装置乙可除去乙烯中混有的乙炔;③装置丙可验证HCl气体在水中的溶解性;④装置丁可用于实验室制取乙酸乙酯;⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.
A.①③⑤
B.③⑤
C.①②④
D.③④
参考答案:①在装置中,金属Fe做电解池的阳极,电极本身失电子,更易生锈,故①错误;
②高锰酸钾具有氧化性,可以将乙烯以及乙炔氧化为二氧化碳,不能用装置乙可除去乙烯中混有的乙炔,故②错误;
③氯化氢极易溶于水,挤压胶头滴管,则集气瓶中压强减小,所以气球鼓起来,可以使用该装置验证HCl气体在水中的溶解性,故③正确;
④乙酸乙酯可以用饱和碳酸钠来吸收,不能用氢氧化钠,乙酸乙酯在氢氧化钠中水解,故④错误;
⑤装置可以收集气体,当集气瓶来用,导管长进短出时,可以收集密度大于空气的气体,如:CO2、Cl2、HCl、NO2等气体,如果导管短进长出,则可以收集密度小于空气的气体,如氢气,故⑤正确.
故选B.
本题解析:
本题难度:简单
4、计算题 (4分)工业上用饱和电解食盐水来制取氯气。现取500mL 含NaCl为11.7g的饱和食盐水进行电解。
⑴在标准状况下制得Cl2多少升?
⑵所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
参考答案:(4分)(1)2.24L?(2分); (2)0.4mol/L?(2分)
本题解析:略
本题难度:一般
5、选择题 下列关于钢铁腐蚀的叙述中正确的是( )
A.吸氧腐蚀时正极放出氧气
B.析氢腐蚀时正极放出氢气
C.化学腐蚀速率超过电化学腐蚀速率
D.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
参考答案:A、吸氧腐蚀正极是氧气得到电子生成氢氧根离子,电极反应为:O2+2H2O+4e-=4OH-,故A错误;
B、析氢腐蚀正极是氢离子得到电子生成氢气,电极反应为2H++2e-=H2↑,故B正确;
C、如果没有形成原电池,在金属变成金属离子溶进水中和水中的氢离子变成氢气,是在同一个地方发生的,这样金属离子在水中扩散时,会和氢离子发生碰撞,阻碍氢离子和金属单质的接触,所以化学反应速率较慢.如果形成了原电池,金属离子在负极上扩散到溶液中,而氢离子在正极上变成氢气,不会被阻碍,所以化学反应速率较快,故C错误;
D、在入海口的钢铁闸门上装一定数量的铜块,铁和铜在海水中形成原电池反应,铁做负极被氧化,发生电化腐蚀,故D错误;
故选B.
本题解析:
本题难度:简单
|