1、选择题 出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
[? ]
A.锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡可对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比在干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
参考答案:BC
本题解析:
本题难度:一般
2、选择题 分别放置在如图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是
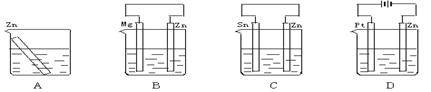 ?
?
参考答案:D
本题解析:根据装置图可知,A是锌的化学腐蚀。B、C都是原电池。由于镁的金属性强于锌的,而锌的金属性强于Sn的,因此B中锌是正极,被保护。C中锌是负极,加速腐蚀。E是电解池,锌和电源的负极相连,作阴极,被保护,所以腐蚀最慢的是选项D,答案选D。
点评:该题是中等难度的试题,试题基础性强,侧重考查学生对金属腐蚀与防护原理的了解掌握程度,有利于培养学生的逻辑推理能力,提高学生的灵活应变能力和应试能力。
本题难度:简单
3、选择题 下列叙述的方法不正确的是
[? ]
A.金属的电化学腐蚀比化学腐蚀更普遍?
B.用铝质铆钉铆接铁板,铁板易被腐蚀
C.钢铁在干燥空气中不易被腐蚀?
D.用牺牲锌块的方法来保护船身
参考答案:B
本题解析:
本题难度:简单
4、填空题 钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大 量?资金.请回答钢铁腐蚀与防护过程中的有关问题.

(1)钢铁的电化学腐蚀原理,在酸性环境中发生析氢腐蚀,在中性或碱性环境中发生吸氧腐蚀。
①分别写出图1中铁电极和石墨电极的电极反应式:
??,?。
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在图1虚线框内所示
位置作出修改,并用箭头标出导线中电子流动方向。
③写出修改后石墨电极的电极反应式??。
(2)工业上常用盐酸除去铁锈.现将一生锈的铁片放入盐酸中,溶液中可能发生的化学反应的化学方程式有 ?。
(3)在实际生产中,可在铁制品的表面镀铜防止铁被腐蚀.装置示意如图2:
①A电极对应的金属是(写元素名称)?,B电极的电极反应式是?,
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为?mol 。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因?。
参考答案:(1)①Fe-2e- =Fe2+? O2+4e-+2H2O=4OH-?(2分)
?②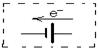 ?(2分)③2Cl--2e-=Cl2↑(1分)
?(2分)③2Cl--2e-=Cl2↑(1分)
(2)Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑ 2FeCl3+Fe=3FeCl2(3分)
(3)①铜?Cu2++2e-═Cu (2分)② 0.08mol(2分)
③铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀(2分)
本题解析:(1)①图1为原电池,Fe作负极,发生Fe-2e- =Fe2+石墨作正极,发生O2+4e-+2H2O=4OH;②利用阴极保护法,在虚线框内添加外电源,使铁作阴极,电子流动方向与电流相反, 
③修改后石墨为阳极,氯离子放电,2Cl--2e-=Cl2↑
(2)铁锈成分为Fe2O3,可与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O,铁与盐酸反应:Fe+2HCl=FeCl2+H2↑,FeCl3与Fe反应:2FeCl3+Fe=3FeCl2
(3)①铁制品表面镀铜,则铁做阴极铜作阳极,A电极是阳极,应为铜,B电极是铜离子的电子还原为铜,反应式为Cu2++2e-═Cu;
②二者质量差为5.12g,说明有2.56g铜被氧化,转移电子物质的量2.56g/64g/mol×2=0.08mol③镀铜铁中铁比铜活泼,镀层破换后在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀
本题难度:一般
5、计算题 (6分)在由铜片、锌片和200 mL一定浓度的稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,请填空并计算:
①正极的电极反应式为??;负极的电极反应式为??;
②通过导线的电子的物质的量;
③求原稀硫酸的物质的量浓度。
参考答案:

本题解析:略
本题难度:一般