1、填空题 为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A、B、C所示。

(1)在相同条件下,三种气体在水中溶解度最大的是________(写化学式)写出A烧杯中发生反应的化学方程式:____?。如果在三只烧杯中分别滴几滴紫色石蕊试液,可观察到的现象是_____________________?。
实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图D、E、F所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。
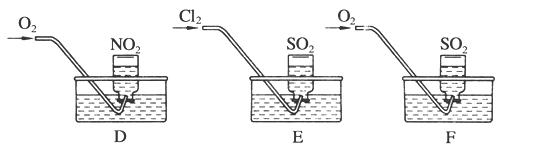
(2)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:
_______________________________________________。
②假设该实验条件下,气体摩尔体积为a L·mol-1。则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________________。
(3) 写出实验F通入氧气后,发生反应的化学方程式:____________________________。
(4)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,可能观察到的现象为________,用有关的离子方程式解释原因:________________________。
参考答案:(1)NO2
3NO2+H2O=2HNO3+NO?溶液都变红色
(2)①4NO2+O2+2H2O=4HNO3?②1/a mol·L-1
(3) 2SO2+O2+2H2O=2H2SO4
(4)出现白色沉淀? Cl2+SO2+2H2O=2Cl-+SO+4H+? Ba2++SO=BaSO4↓
本题解析:(1)NO2在水中的溶解度最大;A试管剩余气体的体积为试管体积的1/3,所以A中气体为NO2,NO2与H2O反应的方程式为:3NO2+H2O=2HNO3+NO;SO2与H2O反应生成H2SO3,NO2与H2O反应生成HNO3,CO2与水反应生成H2CO3,都显酸性,滴入石蕊试液变红。
(2)①由3NO2+H2O=2HNO3+NO和2NO+O2=2NO2,可推出总反应化学方程式为:4NO2+O2+2H2O=4HNO3
②设集气瓶的体积为VL,则充满的NO2也为VL,HNO3的浓度为:VL÷aL/mol÷VL=1/a mol·L-1。
(3)O2氧化SO2,化学方程式为: 2SO2+O2+2H2O=2H2SO4
(4)Cl2在H2O存在的条件下把SO2氧化,生成SO42?,SO42?与Ba2+反应生成BaSO4沉淀,试液现象为:出现白色沉淀;反应的离子方程式为:Cl2+SO2+2H2O=2Cl-+SO+4H+ Ba2++SO=BaSO4↓。
本题难度:一般
2、选择题 下列实验现象的描述错误的是( )
A.向石蕊试液中通入二氧化硫气体,石蕊试液先变红后褪色
B.向石蕊试液中加入新制氯水,石蕊试液先变红后褪色
C.向淀粉KI溶液中滴加新制氯水,溶液变蓝色
D.在新制氯水和久置氯水中滴加AgNO3溶液都有白色沉淀生成
参考答案:A、二氧化硫溶于水得亚硫酸溶液使溶液呈酸性,石蕊试液遇酸变红色;二氧化硫能使酸碱指示剂变色而不使其褪色,故A错误;
B、氯水中含有次氯酸和盐酸,石蕊试液遇酸变红色,所以溶液先变红;次氯酸的强氧化性使红色石蕊试液褪色,所以向石蕊试液中加入新制氯水,石蕊试液先变红后褪色,故B正确;
C、氯水中的氯气能置换碘化钾溶液中的碘,碘遇淀粉变蓝色,所以向淀粉KI溶液中滴加新制氯水,溶液变蓝色,故C正确;
D、无论新制氯水还是久制氯水中都含有盐酸,盐酸和硝酸银溶液反应生成白色沉淀氯化银,故在新制氯水和久置氯水中滴加AgNO3溶液都有白色沉淀生成,故D正确.
故选A.
本题解析:
本题难度:简单
3、选择题 化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2=2HCl推测:H2+Br2=2HBr。但类比是相对的,如根据2Na2O2+2CO2= Na2CO3+ O2,?类2Na2O2+2SO2= Na2SO3+ O2是错误的,应该是Na2O2+SO2= Na2SO4。
下列各组类比中正确的是?(?)
A.由NH4Cl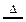 NH3↑+HCl↑,推测:NH4I
NH3↑+HCl↑,推测:NH4I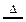 NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O=Ca(HCO3)2+2HClO,推测:CO2+NaClO+H2O=NaHCO3+HClO
D.由Na2SO3+2HCl=2NaCl+H2O+ SO2↑,推测:Na2SO3+2HNO3=2NaNO3+H2O+ SO2↑
参考答案:C
本题解析:本题考查元素化合物知识的一般规律及特殊性,NH4I受热分解为 NH3、I2、H2, SO2和Ca(ClO)2应发生氧化还原Na2SO3和HNO3也要发生氧化还原。故选C
本题难度:一般
4、选择题 已知在热的碱性溶液中,NaClO发生如下反应:3NaClO=2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
[? ]
A.NaCl、NaClO
B.NaCl、NaClO3
C.NaClO、NaClO3
D.NaClO3、NaClO4
参考答案:B
本题解析:
本题难度:简单
5、选择题 某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示。
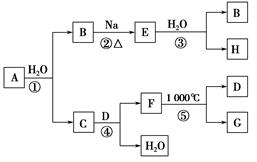
下列说法正确的是? ( )。
A.反应①、③中H2O均是还原剂
B.工业上常用C的悬浊液与Cl2反应制取漂白粉
C.D与H溶液反应后所得溶液的溶质成分有三种可能
D.电解F与盐酸反应后的溶液以制取单质A
参考答案:B
本题解析:ⅡA族元素有Be、Mg、Ca等,由在自然界中广泛存在可知是Ca,则B为H2,E为NaH,H为NaOH,C为Ca(OH)2,由F在1000 ℃分解且是钙常见化合物,可知F为CaCO3。在反应①、③中均有H2生成,H2O均作氧化剂,A错误;工业上制漂白粉是用Ca(OH)2悬浊液和Cl2反应制得,B项正确;NaOH与CO2反应溶液的组成可能为:NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3四种可能,C错误;钙是活泼金属不能通过电解溶液获得,D错误。
本题难度:一般