1、填空题 (8分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
化学方程式
| K (T1 )
| K (T2)
|
F2+H2 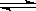 2HF? 2HF?
| 1.8 ×1036
| 1.9 ×1032
|
Cl2+H2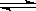 ?2HCl? ?2HCl?
| 9.7 ×1012
| 4.2 ×1011
|
Br2+H2 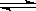 ?2HBr ?2HBr
| 5.6 ×107
| 9.3 ×106
|
I2+H2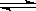 ?2HI ?2HI
| 43
| 34
|
(1)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a.在相同条件下,X2的平衡转化率逐渐降低? b. X2与H2反应的剧烈程度逐渐减弱
c. HX的稳定性逐渐减弱? d. HX的还原性逐渐减弱
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
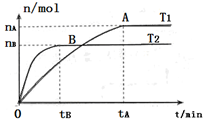
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=__________
②分析右图所示图像,下列说法正确的是________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(3)加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+)?b. Ka(HF)? c. c(F-)/c(H+)? d. c(H+) / c(HF)
参考答案:(1)ac(2)①nA/6tA?②c?(3)d
本题解析:(1)平衡常数越大,反应物的转化率越大,即反应正向程度越大,因此氢化物的稳定性就越强。
(2)①根据图像可知在在0~tAmin内,生成的碘化氢是nAmol,则消耗氢气是0.5 nAmol,所以反应速率是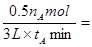 nA/6tAmol/(L·min)。
nA/6tAmol/(L·min)。
②因为反应前后体积不变,所以混合气的密度始终是不变的。B点最先达到平衡状态,所以B点对应的温度高。由A点到B点碘化氢的物质的量减少,平衡向逆反应方向移动,所以n(HI)/n(H2)减小。降低温度,平衡向逆反应方向移动,所以正反应是吸热反应。
(4)HF属于弱电解质,存在电离平衡HF F-+H+。稀释有利于电离,即在稀释过程中氢离子和氟离子的物质的量是增加的,但其浓度是增大的,所以OH-的浓度是增大的。HF的物质的量是减小的,浓度也是减小的。电离度和温度有关,稀释是不变的,因此正确的答案是d。
F-+H+。稀释有利于电离,即在稀释过程中氢离子和氟离子的物质的量是增加的,但其浓度是增大的,所以OH-的浓度是增大的。HF的物质的量是减小的,浓度也是减小的。电离度和温度有关,稀释是不变的,因此正确的答案是d。
本题难度:一般
2、填空题 (12分)现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
(1)已知1 mol N2(g)与适量H2(g)完全反应,当生成NH3(g)0.1mol时,放出9.22kJ热量,写出反应的热化学方程式:?。
(2)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1?K2(填“>”? “="”" 或 “<” )。
(3)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为?,用氮气表示的反应速率:?。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:?(任意写一条)。
(4)在上述相同条件下,若起始时加入4 mol NH3、2 mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中?(填“大”、“小”或“相等”)。
(5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。在电解法合成氨的电解池中?(填“能”或“不能”) 用水作电解质溶液的溶剂,原因是?。
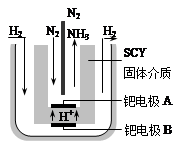
钯电极A是电解池的?极(填“阳”或“阴”),该极上的电极反应式是?。
参考答案:(1)N2(g)+3H2(g) ?2NH3(g)?△H =-184.4 kJ·mol-1? (2分)
?2NH3(g)?△H =-184.4 kJ·mol-1? (2分)
(2) > (1分)
(3)25% (2分) ;0.01mol/(L·min) (1分);增大氢气浓度或增大氮气浓度或增大反应物浓度或降温或增大压强或及时转移走生成的氨(其它合理答案均得分)(1分)
(4)相等 (1分)
(5)不能;新法合成氨电解池的反应温度是570℃时,水为水蒸气;
阴; N2?+ 6e-+6H+ ="=" 2NH3 ?(4分,各1分)
本题解析:(1)在热化学方程式中,物质的系数表示参加该反应的各物质的物质的量:生成NH3(g)0.1mol时,放出9.22kJ热量,则生成NH3(g)2mol时,放出9.22kJ×20="184.4" kJ热量,故正确的热化学方程式为:N2(g)+3H2(g) ?2NH3(g)?△H =-184.4 kJ·mol-1;
?2NH3(g)?△H =-184.4 kJ·mol-1;
(2)由(1)得:△H<0,正向为放热反应,升温平衡逆向移动,则K1>K2;
(3) N2(g)+3H2(g) ?2NH3(g)
?2NH3(g)
n0? 2mol? 8mol? 0
△n? x? 3x? 2x
n(平衡) 2-x? 8-3x? 2x
由PV=nRT,得:在恒温、恒容条件下,P1/P2=n1/n2,
即P1/(80%×P1)=(2mol+8mol)/[(2-x)+(8-3x)+2x],求解,得:x="1" mol;
氨气的体积分数=2x/[(2-x)+(8-3x)+2x]= 25%;
用氮气表示的反应速率=(2x/10)mol·L-1÷10 min=0.01mol/(L·min);
若想提高氨气的产率,即使平衡正向移动;
(4)N2(g)+3H2(g) ?2NH3(g)
?2NH3(g)
n0’ 0? 2mol? 4mol
与(3)的初始态相当,则(3)、(4)为“等效平衡”关系,故反应达到平衡时NH3的体积分数比(3)中相等;
(5)有图,得:向A极通入氮气,反应后生成氨气,则N由0价降低为-3价,也就是说N发生了得电子的还原反应,而发生还原反应的电极定义为阴极
本题难度:一般
3、计算题 (12分)氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化。
(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1?T2(填“>”、“<”或“=”);A、C两点的速率vA ?vC(同上)。
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1?T2(填“>”、“<”或“=”);A、C两点的速率vA ?vC(同上)。

(2)在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
|
n(NO2)/mol
| 0.40
| n1
| 0.26
| n3
| n4
|
n(N2O4)/mol
| 0.00
| 0.05
| n2
| 0.08
| 0.08
|
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为?。
②100℃时,反应2NO2(g) N2O4(g)的平衡常数K的值为?。
N2O4(g)的平衡常数K的值为?。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是?mol/L
④计算③中条件下达到平衡后混合气体的平均相对分子质量为?。(结果保留小数点后一位)
参考答案:(1)<?;?<?。(2)①? 0.0025 mol·L-1·s-1(单位1分)。②? 2.78 。 ③? 0.1 。④? 57.5 。
本题解析:N2O4(g) 2NO2(g) △H>0? P1时,T1?T2二氧化氮的分数增加,向正向进行,正向是吸热反应,所以温度升高T1<T2.从反应开始直至20s时,v(NO2)=" 0.0025" mol·L-1·s-1
2NO2(g) △H>0? P1时,T1?T2二氧化氮的分数增加,向正向进行,正向是吸热反应,所以温度升高T1<T2.从反应开始直至20s时,v(NO2)=" 0.0025" mol·L-1·s-1
N2O4(g) 2NO2(g)平衡常数K=0.122/0.04
2NO2(g)平衡常数K=0.122/0.04
0mol? 0.4mol
0.08mol? 0.16mol
0.08mol? 0.24mol
本题难度:一般
4、选择题 在某温度下,将H2(g)和I2(g)各0.1mol的气体混合物充入10L的密闭容器中,充分反应,达到平衡时,测得c(H2)=0.0080mol/L求:
(1)求该反应的平衡常数。(4分)
(2)在上述温度下,该容器中若充入的H2(g)和I2(g)各0.2mol,求达到化学平衡时HI(g)的平衡浓度。(4分)
参考答案:0.25?C(HI)=0.008mol·L-1
本题解析:(1)依题意可知,平衡时[H2]=[I2]=0.0080mol/L,
H2(g) + I2(g)  2HI(g)
2HI(g)
起始时各物质的浓度(mol·L-1)? 0.010?0.010?0
各物质的浓度变化量(mol·L-1)?0.0020?0.0020?0.0040
平衡时各物质的浓度(mol·L-1)?0.0080?0.0080?0.0040
根据平衡常数的概念可得K= C(HI)2/C(H2)C(I2)="(0.0040" mol·L-1)2/(0.0080 mol·L-1)2=0.25?( 4分)
(2)此温度下,起始量分别是c(H2)=0.02mol/L、c(I2)=0.02mol/L
H2(g) + I2(g)  2HI(g)
2HI(g)
起始时各物质的浓度(mol·L-1)?0.02?0.02?0
各物质的浓度变化量(mol·L-1)? x?x?2x
平衡时各物质的浓度(mol·L-1)? 0.02-x? 0.02-x?2x
K=C(HI)2/C(H2)C(I2)=(2x)2/[(0.02-x)×(0.02-x)]="0.25"
解得:x="0.004" mol/L;
故平衡时C(HI)=0.008mol·L-1。?(4分)
本题难度:一般
5、选择题 N2 +3 H2  2NH3现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生,下列有关说法正确的是(?)
2NH3现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生,下列有关说法正确的是(?)
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正、逆反应速率为0
参考答案:C
本题解析:考查可逆反应的特点及平衡状态的判断和理解。反应是可逆反应,所以转化率不可能是100%的,A不正确。平衡时各种物质的浓度和含量不再发生变化,但物质之间的浓度不一定相等,B不正确,C正确。平衡时正逆反应速率相等,但不等于0,D不正确。答案选C。
本题难度:一般