1、选择题 在镁与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,则10s内生成氢气的平均反应速率是
[? ]
A.0.06mol/L·s
B.1.8mol/L·s
C.1.2mol/L·s
D.0.18mol/L·s
参考答案:A
本题解析:
本题难度:简单
2、选择题 一定温度条件下,在固定体积的密闭容器中发生反应A(s)+ 2B(g) C(g)+ D(g),能说明该反应达到平衡状态的标志是
C(g)+ D(g),能说明该反应达到平衡状态的标志是
A.平衡体系的总压不变
B.平衡混合气体的平均相对分子质量不变
C.C 和D的物质的量相等
D.平衡混合气体的总物质的量不变
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。反应前后体积是不变的,因此压强和气体总的我知道始终是不变的,AD不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,物质的量不变,但质量是变化的,所以B可以说明。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,C不正确,答案选B。
本题难度:一般
3、选择题 下列事实不能用勒夏特列原理解释的是(?)
A.煅烧粉碎的硫铁矿利于SO2的生成
B.对2HI(g)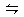 I2(g)+H2(g),增大压强可使平衡体系颜色变深
I2(g)+H2(g),增大压强可使平衡体系颜色变深
C.反应NO2+CO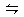 CO2+NO;ΔH<0,升高温度可使平衡向逆反应方向移动
CO2+NO;ΔH<0,升高温度可使平衡向逆反应方向移动
D.合成NH3反应:N2+3H2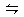 2NH3ΔH<0,为提高NH3的产率,理论上应采取降低温度的措施
2NH3ΔH<0,为提高NH3的产率,理论上应采取降低温度的措施
参考答案:AB
本题解析:用勒夏特列原理解释实际问题时,必须引起平衡的移动,且移动的方向与反应实际的要求平衡移动相一致。A项只是采取加快反应速率措施,对平衡移动没影响;B项改变压强,平衡不移动,平衡体系颜色变深只是反应混合物的浓度加深。
本题难度:一般
4、选择题 图中表示外界条件(T、P)的变化对下列反应的影响:L(s)+G(g) 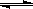 ?2R(g);△H>0 ,y 轴表示的是
?2R(g);△H>0 ,y 轴表示的是
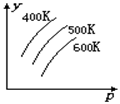
A.平衡时,混合气中R的百分含量
B.平衡时,混合气中G的百分含量
C.G的转化率
D.L的转化率
参考答案:B
本题解析:该可逆反应是气体系数增大的吸热反应,其中L为固体
从图像可知,加压,平衡左移,Y值增大;升温,平衡正向移动,Y值减小
A:加压,平衡左移,混合气中R的百分含量减小,排除
B:正确
C:加压,平衡左移,G的转化率减小,不符合题意,排除
D:L为固体,浓度一般认为是定值,不改变,排除
答案为B
本题难度:一般
5、选择题 在恒温下的密闭容器中,有可逆反应:2NO+O2 2NO2(正反应为放热反应),不能说明已经达到平衡状态的是( )
2NO2(正反应为放热反应),不能说明已经达到平衡状态的是( )
A.正反应生成NO2的速率和逆反应生成O2的速率相等
B.反应容器中压强不随时间的变化而变化
C.混合气体颜色保持不变
D.混合气体的平均相对分子质量不随时间变化而变化
参考答案:A
本题解析:该反应是一个反应前后气体物质的量不等的反应,因此混合气体的平均相对分子质量、压强不随时间变化而变化以及颜色保持不变,说明达到平衡。A中表示的速率虽然方向相反,但速率之比不等于方程式计量数之比,故A错。
本题难度:一般