1、填空题 小刚、小军、小红对一久置的NaOH白色粉末的成分进行探究。
三位同学都作出以下的猜想:
Ⅰ.①可能是NaOH; ②可能是Na2CO3; ③可能是NaOH与Na2CO3的混合物。
做出②③猜想的依据是______________________________(用化学方程式表示)
Ⅱ.为了验证①②③猜想,他们分别做了下面的实验。
(1)小刚取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中一定含有?,可肯定猜想________(填序号)是错误的。
(2)小军又取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色。由此小军结合小刚的实验,认为猜想③是正确的。小红却认为小军的所得结论不确切,因为
?。
(3)为探究白色粉末是否含有NaOH,小红设计了如下实验方案: 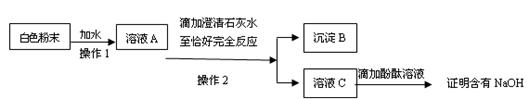
①沉淀B的化学式为____________。
②在操作1中要用到玻璃棒,其作用是_______________;
在操作2中,除要用到铁架台(带铁 圈)、烧杯、滤纸、玻璃棒外,还需补充的玻璃仪器是 _______。
圈)、烧杯、滤纸、玻璃棒外,还需补充的玻璃仪器是 _______。
③小刚认为小红的这个方案也有问题,理由是________________。
Ⅲ.小刚对小红的实验作了正确的改进后进行了 实验,实验现象和小红的一致。由此确定猜想③是正确的
实验,实验现象和小红的一致。由此确定猜想③是正确的 。小刚改进的方法是_______?。
。小刚改进的方法是_______?。
参考答案:Ⅰ.CO2+2NaOH====Na2CO3+H2O
Ⅱ.(1)Na2CO3 ?①?
(2)溶液中存在Na2CO3也会使酚酞变红
(3)①CaCO3
②搅拌,?漏斗
③Na2CO3与Ca(OH)2反应后也有NaOH生成,因此这个方案不能证明白色粉末中是否含有NaOH?
Ⅲ.改进方案:将滴加澄清石灰水改为过量的CaCl2(或Ba(NO3)2或Ca(NO3)2或BaC l2)
l2)
即可。
本题解析:略
本题难度:简单
2、选择题 研究物质性质常用观察、实验、分类、比较等基本方法.下列说法正确的是( )
A.观察是一种有计划、有目的地用感官考察研究对象的方法
B.实验只能探究物质未知的性质,而不能验证对物质性质的预测
C.分类可以总结出各类物质的一般性质,认识物质间的内在规律
D.运用比较的方法可以解决某些实验现象,从而得出正确的结论
参考答案:AC
本题解析:
本题难度:一般
3、实验题 (17分)实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)【猜想】
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
(2)【实验】如下图所示:
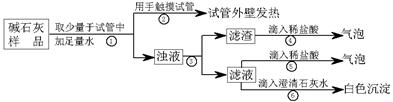
a、CaO与水反应的反应方程式为?。
b、操作③中玻璃棒的作用是?。
c、操作④发生化学反应的离子方程式为?;
(3)【判断】
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ
?(填:成立、不成立)
b.由操作⑤⑥的现象判断:滤液中含有?(写化学式);由此判断猜想Ⅰ
?(填:成立、不成立)。
c.综合a和b的结论,判断该样品变质情况为?。
参考答案:
(2)a. CaO+H2O==Ca(OH)2(3分)
b. 引流,防止溶液外溅(3分)
c. CaCO3+2H+ ==Ca2++CO2↑+H2O(3分)
(3)a.不成立(2分)
b. Na2CO3(2分)?不成立(2分)
c. 部分变质(2分)
本题解析:略
本题难度:简单
4、简答题 在室温下,化学反应I-(aq)+OCl-(aq)=OI-(aq)+Cl-(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 | I-的初始浓度
(mol-L-1) | OCl-的初始浓度
(mol-L-1) | OH-的初始浓度
(mol-L-1) | 初始速率v
(mol-L-1-s-1)
1
2×10-3
1.5×10-3
1.00
1.8×10-4
2
a
1.5×10-3
1.00
3.6×10-4
3
2×10-3
3×10-3
2.00
1.8×10-4
4
4×10-3
3×10-3
1.00
7.2×10-4
|
已知表中初始反应速率与有关离子浓度关系可以表示为v=k[I-]1[OCl-]b[OH-]c(温?度一定时,k为常数)
①为了实施实验1,某同学取5mL0.02mol-L-1碘化钾溶液、5mL0.015mol-L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应.则该氢氧化钠溶液物质的量浓度为______?mol-L-1
②实验2中,a=______
③设计实验2和实验4的目的是______;
④计算b、c值:b=______;c=______
⑤若实验编号4的其它浓度不变,仅将溶液的OH-的初始浓度变为0.1mol-L-1,反应的初始速率v=______(mol-L-1-s-1).
参考答案:①将实验1数据代入公式v=k[I-]1[OCl-]b[OH-]c,可得1.8×10-4mol?L-1?s-1=K[0.002mol?L-1][0.0015mol?L-1]b[1mol?L-1]c设为A式,将实验4代入公式v=k[I-]1[OCl-]b[OH-]c,可得7.2×10-4mol?L-1?s-1=K[0.004mol?L-1][0.003mol?L-1]b[1mol?L-1]c设为B式,将AB两式联合组成方程组求解,可得,b=1,将b=1代入1.8×10-4mol?L-1?s-1=K[0.002mol?L-1][0.0015mol?L-1]b[1mol?L-1]c,可得K=60,将实验3数据代入公式v=k[I-]1[OCl-]b[OH-]c,可得1.8×10-4mol?L-1?s-1=K[0.002mol?L-1][0.003mol?L-1]b[1mol?L-1]c,将b=1,K=60,代入得C=-1,取5mL0.02mol?L-1碘化钾溶液、5mL0.015mol?L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应,溶液的总体积为50mL,则I-的初始浓度为C=nV=0.0001mol0.05L=0.002mol?L-1,OCl-的初始浓度C=nV=0.000075mol0.05L=0.0015mol?L-1,初始速率v=1.8×10-4mol?L-1?s-1,将数据代入公式v=k[I-]1[OCl-]b[OH-]c,可得1.81mol/L×0.05L0.04L10-4mol?L-1?s-1=K[0.002mol?L-1][0.0015mol?L-1]b[OH-]c,将b=1,K=60,C=-1,代入得[OH-]=1mol?L-1,原氢氧化钠溶液为40mL某浓度氢氧化钠溶液,所以原氢氧化钠溶液物质的量浓度为C=nv=1mol/L×0.05L0.04L=1.25mol?L-1,
故答案为:1.25;
②根据①的分析知:b=1,K=60,C=-1,联合实验数据2代入公式v=k[I-]1[OCl-]b[OH-]c,可得3.6×10-4mol?L-1?s-1=K[a]1[0.0015mol?L-1]1[1mol?L-1],可得a=4×10-3,
故答案为:4×10-3;
③根据①的解答,联合实验数据1和4求出b,对照实验2和实验4的数据的异同点,不同的数据有助于探究OCl-离子对反应速率的影响,
故答案为:探究OCl-离子对反应速率的影响;
④由①的解答知b=1,K=60,c=-1,故答案为:1;-1;
⑤将b=1,K=60,C=-1,代入得公式v=k[I-]1[OCl-]b[OH-]c,得v=60[I-]1[OCl-]b[OH-]-1,将OH-的初始浓度变为0.1mol?L-1,I-的初始浓度为4×10-3mol?L-1,OCl-的初始浓度为3×10-3mol?L-1,代入得反应的初始速率v=7.2×10-3mol?L-1?s-1,故答案为:7.2×10-3mol?L-1?s-1.
本题解析:
本题难度:一般
5、实验题 甲、乙两同学为探究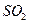 与可溶性钡的强酸盐能否反应生成白色BaSO3?沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
与可溶性钡的强酸盐能否反应生成白色BaSO3?沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
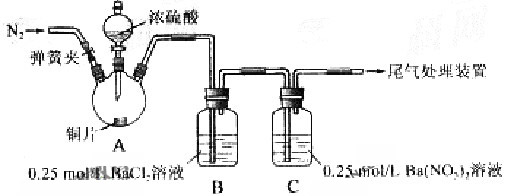
实验操作和现象:
操作
| 现象
|
关闭弹簧夹,滴加一定量浓硫酸,加热
| A中有白雾生成,铜片表面产生气泡
B中有气泡冒出,产生大量白色沉淀
C中 产生白色沉淀,液面上放略显浅棕色并逐渐消失 产生白色沉淀,液面上放略显浅棕色并逐渐消失
|
打开弹簧夹,通入N2,
停止加热,一段时间后关闭
| ? ___________________
|
从B、C中分别取少量白色沉淀,加稀盐酸
| 尚未发现白色沉淀溶解
|
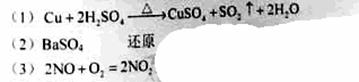
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是__________________,该沉淀的生成表明SO2具有___________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_____________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是_____________;
乙在A、B间增加洗气瓶D,D中盛放的试剂是_____________。
②进行实验,B中现象:
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:__________。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_______________。
参考答案:

本题解析:略
本题难度:一般