1、选择题 对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是( )
A.加入一种反应物
B.升高温度
C.对平衡体系增加压强
D.使用催化剂
参考答案:A、在反应中,加入一种故体反应物,固体量的增减不会引起化学平衡的移动,故A错误;
B、任何化学反应一定伴随能量的变化,升高温度,化学平衡一定是向着吸热方向进行,故B正确;
C、对于没有气体参加的反应,或是前后气体体积不变的反应,压强不会引起平衡的移动,故C错误;
D、使用催化剂只能改变化学反应的速率,不会引起化学平衡的移动,故D错误.
故选B.
本题解析:
本题难度:一般
2、选择题 下列有关说法正确的是
A.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L-1的NaOH标准溶液
B.催化剂可以加快化学反应速率但不能改变化学反应的焓变
C.100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱
D.对于反应2SO2(g)+O2(g)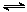 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
参考答案:BC
本题解析:A. NaOH在空气中易变质,不可能得到NaOH标准溶液,错误;B正确;C.HB放出的氢气多,说明其中含有较多的未电离的分子,说明HB酸性比HA弱,正确;D.平衡常数K只与温度有关,不会受压强的影响,错误;
本题难度:一般
3、计算题 (9分)恒温下,将a mol N2和b mol H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.92倍,试求:
(1)反应前混合气体中N2和H2的体积比a
参考答案:
本题解析:
本题难度:一般
4、填空题 (1)一定条件下的密闭容器中,反应3H2(g)+3CO(g) CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.升高温度 b.加入催化剂 c.减小CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
| CH3OH
| CH3OCH3
| H2O
|
浓度/(mol·L-1)
| 0.44
| 0.6
| 0.6
|
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
参考答案: (1)c、e (2)①> ②0.04 mol·L-1 0.16 mol·(L·min)-1
本题解析: (1)正反应是放热反应,升高温度平衡左移,CO转化率减小;加入催化剂,平衡不移动,转化率不变;减少CO2的浓度、分离出二甲醚,平衡右移,CO转化率增大;增大CO浓度,平衡右移,但CO转化率降低,故选c、e。
(2)此时的浓度商Qc==1.86<400,反应未达到平衡状态,向正反应方向移动,故v(正)>v(逆);设平衡时生成物的浓度为(0.6 mol·L-1+x),则甲醇的浓度为(0.44 mol·L-1-2x),根据平衡常数表达式400=,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
由表可知,甲醇的起始浓度为(0.44+1.2) mol·L-1=1.64 mol·L-1,其平衡浓度为0.04 mol·L-1,10 min内变化的浓度为1.6 mol·L-1,故v(CH3OH)=0.16 mol·(L·min)-1。
考点:平衡常数、平衡移动
本题难度:一般
5、选择题 在mA(气)+nB(气) pC(气)+qD(气)反应中,经10min达平衡,此时各物质的浓度变化为:A减少amol/L,B减少a/3?mol/L,C增加2a/3?mol/L,此时若给体系加压,化学平衡不移动,则m:n:p:q为?
pC(气)+qD(气)反应中,经10min达平衡,此时各物质的浓度变化为:A减少amol/L,B减少a/3?mol/L,C增加2a/3?mol/L,此时若给体系加压,化学平衡不移动,则m:n:p:q为?
[? ]
A.1:1:1:1?
B.1:3:3:1
C.1:3:2:2?
D.3:1:2:2
参考答案:D
本题解析:
本题难度:一般