1、填空题 常温下,两种溶液① 0.1 mol?L-1 NH3·H2O ② 0.1 mol?L-1 NH4Cl中:
(1)溶液①的pH 7(填“>”、“<”或“=”),其原因是: (用电离方程式表示)。
(2)溶液②呈 性(填“酸”、“碱”或“中”)。水解反应是吸热反应,升温可以 (填“促进”或“抑制”)NH4Cl的水解。
(3)下列关于两种溶液中c(NH4+) 的叙述正确的是 (填字母)。
a.两种溶液中c(NH4+) 都等于0.1 mol?L-1
b.两种溶液中c(NH4+) 都小于0.1 mol?L-1
c.NH4Cl溶液中c(NH4+) 小于NH3·H2O溶液中c(NH4+)
2、计算题 (12分)在一定温度下,向容积不变的容器中加入2 mol N2、8 mol H2及固体催化剂,使之反应。已知:N2(g)+3H2(g)  2NH3(g) ΔH=-92.2 kJ· mol-1。平衡时,容器内气体压强为起始时的80%。
2NH3(g) ΔH=-92.2 kJ· mol-1。平衡时,容器内气体压强为起始时的80%。
(1)反应达到平衡时,放出的热量 ( )
A.小于92.2 kJ B.等于92.2 kJ C.大于92.2 kJ
(2)保持同一温度,在相同的容器中,若起始时加入2 mol NH3、1 mol H2及固体催化剂,反应达到平衡时NH3的体积分数 ( )
A.等于0.25 B.大于0.25 C.小于0.25
(3)保持同一温度,在相同的容器中,起始通入一定物质的量N2、H2、NH3,欲使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则充入N2的物质的量a mol的取值范围是_________________________________________。
(4)如图是T1℃时容器中NH3的物质的量随时间的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化曲线。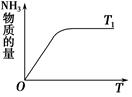
3、选择题 E是非金属性最强的元素,M是E的气态氢化物,在一定体积的密闭容器中,气体M存在如下关系:
xM(g)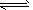 Mx(g ),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
Mx(g ),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
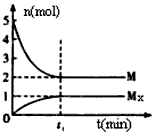
[? ]
A.该反应的化学方程式是2HF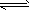 (HF)2
(HF)2
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1molMx,重新达到平衡时,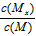 将增大
将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低
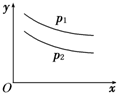
4、选择题 反应L(s)+aG(g)

bR(g)达到平衡时,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
A.上述反应正方向是放热反应
B.上述反应正方向是吸热反应
C.a>b
D.a+1<b