1、选择题 我们的生活离不开能源。下列属于绿色能源的(?)
A.天然气
B.太阳能
C.石油
D.煤
参考答案:B
本题解析:石油、煤、天然气均为化石能源。而太阳能无污染、环保,属绿色能源
本题难度:简单
2、填空题 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式 。?
(2)判断滴定终点的方法是 。?
(3)计算:血液中含钙离子的浓度为 g·mL-1。?
参考答案:(1)2Mn+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
(2)当滴入1滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色
(3)1.0×10-4
本题解析:因为滴加酸性KMnO4溶液至反应完毕过量时,会使溶液呈紫色,故可用滴入一滴酸性KMnO4溶液由无色变为浅紫色且半分钟不褪色的方法来判断终点。由题意知可能发生反应的离子方程式为:2Mn+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O、Ca2++C2
2Mn2++10CO2↑+8H2O、Ca2++C2 CaC2O4↓、CaC2O4+2H+
CaC2O4↓、CaC2O4+2H+ Ca2++H2C2O4。
Ca2++H2C2O4。
设2 mL血液中含Ca2+的物质的量为x,则
5Ca2+~5CaC2O4~5H2C2O4~2Mn
5 2
x 20.0×10-3 L×1.0×10-4 mol·L-1
x=5.0×10-6 mol,1 mL血液中Ca2+的浓度为=1.0×10-4 g·mL-1。
本题难度:一般
3、选择题 向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述错误的是? ( )
A.反应后溶液中c(Na+)=2c(SO42—)
B.a/2mol>沉淀的物质的量>0
C.沉淀的质量=49a g
D.溶液中n(SO42—)=a/2 mol
参考答案:C
本题解析:pH=7时溶液中只有Na2SO4,故A、D对;沉淀是Cu(OH)2,若a mol NaOH全部与CuSO4反应,则生成的沉淀为a/2 mol,而实际上NaOH还与硫酸反应,故B对C错。
本题难度:一般
4、计算题 (8分)25℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合。
(1)若所得溶液的pH=11,且a=13,b=2,则Va︰Vb=??。
(2)若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4 ?(填“可”或“否”)
(3)为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg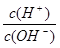 。
。
25℃时,若溶液呈中性,则AG= ??,溶液的pH与AG的换算公式为AG= ??(要简化)。
参考答案:(1)? 1: 9? (2) 可? (3)? 0? -2pH+14
本题解析:(1)混合后溶液pH为11,说明碱过量,则
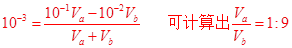
(2)强酸强碱恰好中和则符合公式:

故b值可以等于4
(3)25℃时,若溶液呈中性,则c(H+)=c(OH—),代入AG=lg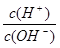 =0
=0
AG=lg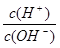 =
=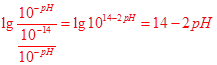
本题难度:一般
5、选择题 用已知物质的量浓度的NaOH溶液测定未知物质的量浓度的盐酸,其操作错误的是
A.酸式滴定管需用待测盐酸润洗
B.碱式滴定管不用标准碱液润洗
C.滴定过程中不能有液体从锥形瓶溅出
D.滴定结束,读数时要平视读数
参考答案:B
本题解析:酸碱滴定过程中,酸式滴定管需用待测盐酸润洗,同样碱式滴定管也要用标准碱液润洗,所以A的操作是正确的,B的操作是错误的,B为本题的答案;滴定过程中不能有液体从锥形瓶溅出,否则会影响滴定的结果,故C正确;滴定结束,读数时要平视读数,故D正确。
点评:本题考查了对酸碱滴定的实验操作正误的判断,酸碱滴定是高中经典的实验之一,是高考考查的重点,本题比较简单。
本题难度:一般