1、选择题 已知25℃时,下列物质的电离常数大小有如下顺序:
H2SO3(一级电离)>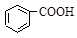 >HSO3->
>HSO3->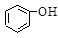 ,水杨酸(
,水杨酸(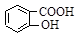 )与亚硫酸钠溶液反应,可能生成的物质是
)与亚硫酸钠溶液反应,可能生成的物质是
A.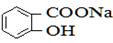
B.SO2
C.NaHSO3
D.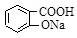
参考答案:AC
本题解析:有题中信息得,电离常数H2SO3(一级电离)>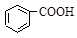 >HSO3->
>HSO3->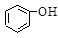 ,即水杨酸(
,即水杨酸(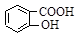 )与亚硫酸钠溶液反应,可能生成的物质是
)与亚硫酸钠溶液反应,可能生成的物质是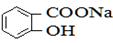 和NaHSO3。故选AC。
和NaHSO3。故选AC。
点评:本题考查的是电离常数的相关知识的,题目难度不大,利用好题中信息是解题的关键。
本题难度:一般
2、填空题 (14分)
(1)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)= 2NO2(g) △H =" +67.7" kJ/mol;
N2H4(g)+ O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为__________________ 。
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为 酸(填“强”或“弱”), H2A的电离方程式为 ,该溶液中由水电离出的c(H+)= 。
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a b(填“>”、“<”或“=”,下同)。
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a b。
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a b
参考答案:(14分)(每空2分)
(1)2N2H4(g) +2NO2(g)==3N2(g)+4H2O(g) △H=-1135.7kJ/mol
(2)弱,H2A H++HA—,10—10mol/L
H++HA—,10—10mol/L
(3)①> ②< ③>
本题解析:略
本题难度:一般
3、填空题 今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:
A.①>②>③ B.①<②<③ C.①=②=③ D.①=③>②
E.①>②=③? F.①<②=③ G.①=②<③ H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是__________。
(2)当它们的物质的量浓度相同时,其pH的关系是__________。
(3)中和等体积、等物质的量浓度的三种酸溶液,需同物质的量浓度的烧碱溶液的体积关系为
__________。
(4)当它们pH相同、体积相同时,同时加入锌,则开始时反应速率大小关系为__________。
(5)将pH相同的三种酸均稀释10倍后,pH关系为__________。
参考答案:(1)A
(2)A
(3)G
(4)C
(5)F
本题解析:
本题难度:一般
4、选择题 下列事实一定能说明HNO2为弱电解质的是
①常温下Na NO2溶液的PH>7 ②10mL1mol/L HNO2恰好与10mL1mol/LNaOH完全反应③HNO2与NaCl不能反应④0.1mol/L HNO2溶液的PH=2.1
A:①②③④ B:②③④ C:①④ D:②④
参考答案:C
本题解析:略
本题难度:一般
5、选择题 体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01mol,下列叙述错误的是( )
A.它们分别与足量CaCO3反应时,放出的CO2一样多
B.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多
C.两种溶液的pH相同
D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
参考答案:n(Cl-)=n(CH3COO-)=0.01mol,溶液中氢离子浓度相等,醋酸是弱酸,部分电离,醋酸的物质的量难度一定大于盐酸的浓度,
A.pH相等的醋酸和盐酸,醋酸的浓度大于盐酸,所以等体积等pH的两种酸,醋酸的物质的量大于盐酸,且二者都是一元酸,则放出二氧化碳体积与酸的物质的量成正比,所以醋酸放出的二氧化碳多,故A错误;
B.醋酸的浓度大于盐酸,与NaOH完全中和时,醋酸溶液所消耗的NaOH多,故B正确;
C.两溶液中氢离子浓度相等,pH相等,故C正确;
D.醋酸是弱电解质,部分电离,稀释后电离程度变大,醋酸根离子物质的量增大,故正确.
故选A.
本题解析:
本题难度:一般